To tylko jedna z 13 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Wiązanie chemiczne
♦ Na czym polega wiązanie chemiczne ?
♦ Dlaczego się tworzy ?
♦ "Pierwiastki dąŜą do uzyskania na
ostatniej powłoce konfiguracji gazu
szlachetnego" Lewis, Kossel,
Langmuir 1916-1919 (tzw. teoria
Lewisa)
♦ Gerardowi N Lewisowi zawdzięczamy
równieŜ sposób prezentacji par
elektronowych (wiązań) jako kresek
lub par kropek
♦ Inaczej mówiąc - pierwiastki "dąŜą"
do uzyskania na ostatniej powłoce
oktetu elektronowego ...
G.N.Lewis
1875 -1946
OKTET
utwór muzyczny dla zespołu złoŜonego z
ośmiu instrumentów
Oktet F-dur op. 166
dwoje skrzypiec, altówka, wiolonczela,
kontrabas, klarnet, fagot, róg
- razem 8 (octo) instrumentów
Taki jest właściwy sens słowa
OKTET
Franciszek Schubert
(1797 - 1828)
Wiązanie chemiczne nie polega na tworzeniu się oktetów,
choć czasem takie tłumaczenie powstania wiązania
chemicznego bywa wystarczające ...
1
Dlaczego tworzy się wiązanie
♥Cząsteczka składa się z dwóch lub więcej
atomów:
♥Składa się zatem z co najmniej dwóch jąder
atomowych i elektronów
♥Oddziaływania:
– Jądro - Jądro
– Jądro - Elektron
– Elektron - Elektron
ODPYCHANIE
PRZYCIĄGANIE
ODPYCHANIE
Dlaczego tworzy się wiązanie chemiczne
♣JeŜeli elektron(y) znajdują się pomiędzy jądrami, to:
* zmniejsza się odpychanie;
* energia całego układu ulega obniŜeniu
♣STANY ENERGETYCZNE elektronów, które
pojawią się w związku z wytworzeniem wiązania,
odpowiadają niŜszym energiom niŜ w
izolowanych atomach
♣Taka jest prawdziwa przyczyna tworzenia się
wiązania chemicznego...
2
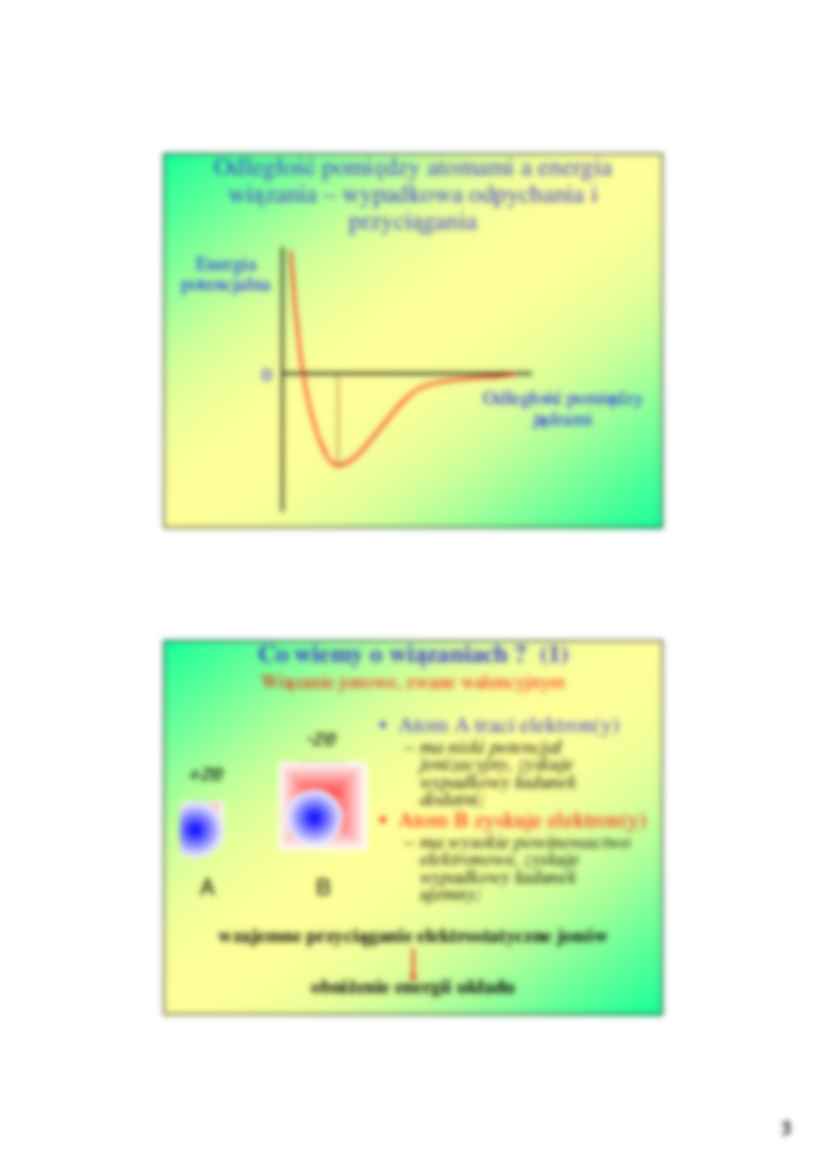
Odległość pomiędzy atomami a energia
wiązania – wypadkowa odpychania i
przyciągania
Energia
potencjalna
0
Odległość pomiędzy
jądrami
Co wiemy o wiązaniach ? (1)
Wiązanie jonowe, zwane walencyjnym
-ze
+ze
• Atom A traci elektron(y)
– ma niski potencjał
jonizacyjny, zyskuje
wypadkowy ładunek
dodatni;
• Atom B zyskuje elektron(y)
A
B
– ma wysokie powinowactwo
elektronowe, zyskuje
wypadkowy ładunek
ujemny;
wzajemne przyciąganie elektrostatyczne jonów
obniŜenie energii układu
3
Co wiemy o wiązaniach ? (2)
Atomy A i B "wspólnie
posiadają"elektrony z
zewnętrznych powłok
(pary elektronowe)
-ne
+ze
A
+z’e
B
Gęstość elektronowa
pomiędzy jądrami rośnie
zmniejsza się odpychanie
obniŜa się energia układu ...
Co wiemy o wiązaniach ? (3)
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
• Elektrony walencyjne
tworzą rodzaj "gazu
elektronowego"
otaczajacego dodatnie
zręby atomowe (jądro
+ elektrony z niŜszych
powłok)
Gęstość elektronowa pomiędzy dodatnimi zrębami rośnie
zmniejsza się odpychanie
energia układu zmniejsza się
4
A co na to mechanika kwantowa ?
$
HΨ = EΨ
2
• ZałoŜenie:
jądra są nieskończenie cięŜkie
nie poruszają się
A
1
B
rAB jest stałe
V = Vjj + Vje + Vee
Równanie Schrödingera dla cząsteczki
* Skoro moŜna napisać wyraŜenie na energię
całkowitą, uwzględniające wszystkie
oddziaływania, to moŜna napisać takŜe równanie
Schrödingera;
* Nie ma jednak żadnych szans na jego
rozwiązanie,borównanie jest jeszcze bardziej
rozwiązanie,boró
skomplikowane niż dla atomu
(…)
… dokonywania
obliczeń
przybliŜenie jednoelektronowe, co oznacza, Ŝe
stan kaŜdego elektronu ("z osobna") opisuje
spinorbital molekularny фk (i)
funkcja falowa całego układu jest iloczynem
funkcji "jednoelektronowych"
Φ = φ1 (1) ⋅ φ2 (2) ⋅ φ3 (3).......φ N ( N )
Metoda orbitali molekularnych - MO
Pierwszy problem - skąd wziąć orbitale
cząsteczkowe (molekularne) „jednoelektronowe” ?
Najlepiej za punkt wyjścia przyjąć orbitale atomów,
z których powstała cząsteczka ...
LCAO MO
Linear Combination of Atomic Orbitals →
Molecular Orbitals
Kombinacja Liniowa Orbitali Atomowych →
Orbitale Molekularne
6
LCAO MO
ΨM = c A ⋅ψ A + cB ⋅ψ B
ΨM ψA, ψB cA, cB -
„jednoelektronowy” orbital molekularny
orbitale atomowe atomów A i B
współczynniki określające udział
kaŜdego z orbitali atomowych
BARDZO WAśNE !
Liczba wynikowych…
... zobacz całą notatkę






Komentarze użytkowników (0)