To tylko jedna z 25 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


TERMODYNAMIKA CHEMICZNA I TERMOCHEMIA Termodynamika zajmuje się badaniem energii i jej przemian.
Termodynamika chemiczna zajmuje się efektami energetycznymi reakcji chemicznych i towarzyszących im przemian fizycznych , jak np. topnienie, parowanie, rozpuszczanie itp.
Termochemia opisuje efekty cieplne przemian fizykochemicznych zachodzących w układzie .
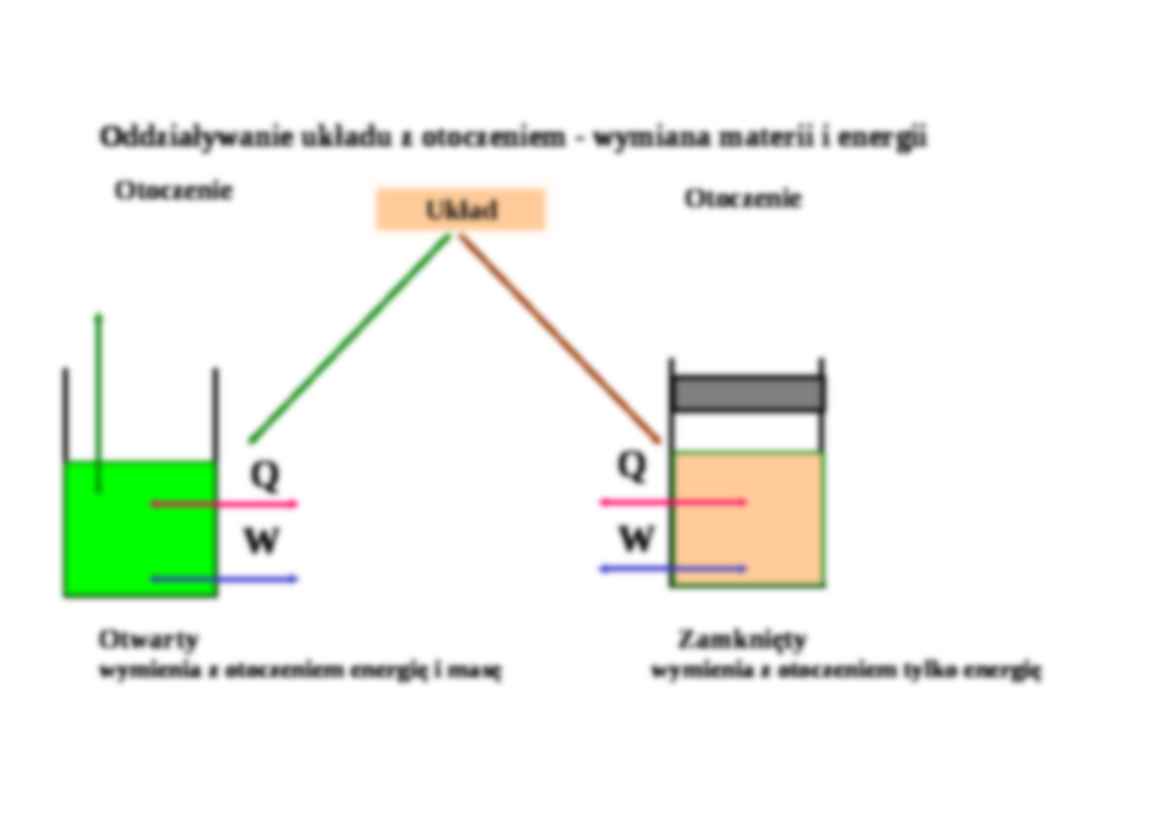
Układem nazywa się wyodrębnioną ilość materii (fragment rzeczywistości) poddany obserwacji bądź rozważaniom teoretycznym. Może to być jedna lub wiele substancji prostych lub złożonych, występujących w różnych stanach skupienia. Poza układem istnieje jego otoczenie . Układ charakteryzuje się za pomocą parametrów stanu układu . Parametry ekstensywne - addytywne (wielkość parametru dla całego układu jest sumą jego wielkości dla poszczególnych składników układu), zależne od ilości i rodzaju składników, wielkości układu, np. masa lub objętość; Parametry intensywne - nie są addytywne, np. temperatura, ciśnienie, gęstość, wielkości molowe. Spos oby przekazywania energii: ♦ na sposób pracy (jako praca) W (praca mechaniczna-zmiany objętości, odkształcenia, praca zmiany powierzchni, elektryczna) ♦ na sposób ciepła (jako ciepło) Q Oddziaływanie układu z otoczeniem - wymiana materii i energii Otwarty Zamknięty wymienia z otoczeniem energię i masę wymienia z otoczeniem tylko energię Ciśnienie p, objętość V i temperatura T są wystarczające do całkowitego scharakteryzowanie stanu układu. Równanie stanu : f (p,V,T) = 0 dla gazu doskonałego : pV = nRT „Zerowa” zasada termodynamiki:
(…)
… przez układ w odwracalnej przemianie izohoryczno-izotermicznej.
Entalpię H i entropię S wiąże funkcja stanu zwana entalpią swobodną (potencjałem termodynamicznym) G:
Zmiana potencjały termodynamicznego w czasie przemiany: W odwracalnych przemianach izobaryczno - izotermicznych zmienia się objętość układu reagującego co oznacza, że praca objętościowa odbywa się kosztem pracy maksymalnej. Stąd:
określa tzw…
… przemiany izobarycznej
w procesie izohorycznym (V=const): stąd: QV - ciepło przemiany izohorycznej.
Dla przemiany izobarycznej: jeżeli: entalpia to: Entalpia (lub zawartość cieplna układu) jest również funkcją stanu układu. Powyższe równania można zapisać jako stwierdzenia:
Ciepło przemiany (reakcji) zachodzącej w stałej objętości jest równe zmianie energii wewnętrznej układu.
Ciepło przemiany (reakcji) zachodzącej pod stałym ciśnieniem jest równe zmianie entalpii układu. Ponadto: Różnica między H i U dla przemiany izobarycznej zależy od wartości tego ciśnienia i od zmiany objętości następującej podczas przemiany (reakcji). W fazie stałej lub ciekłej zmiany objętości są bardzo małe, więc: - p V ~ 0 oraz H ~ U i Qp ~ QV
Bezpośrednia wartość entalpii, podobnie jak energii wewnętrznej…
… izohoryczno-izotermicznych, gdyż:
WNIOSEK:
Z zależności pomiędzy funkcjami stanu układu wynika, że proces samorzutny może zachodzić bez różnicy temperatury, gdy podczas jego przebiegu następuje zmniejszenie entalpii swobodnej.
W taki właśnie sposób, bez różnicy temperatury i pod stałym ciśnieniem przebiega większość procesów w przyrodzie, m.in. biologiczne procesy w organizmach żywych.
Q
W
Otoczenie
Układ…
… początkowego i końcowego układu. Taką właściwość posiadają funkcje stanu układu - energia wewnętrzna jest funkcją stanu układu:
Ciepło i praca zależą od drogi przemiany, nie są więc funkcjami stanu układu.
Elementarnie małe zmiany energii wewnętrznej układu będą określane równaniem:
dU = Q + W
W myśl przyjętej konwencji, gdy ciepło zostaje oddane z układu do otoczenia (proces egzotermiczny) piszemy - Q…
… przeniesienia ciepła Q w stałej temperaturze T wynosi:
[J/mol⋅K]
II zasada termodynamiki może być sformułowana następująco:
W układzie izolowanym przemianie samorzutnej, to znaczy nieodwracalnej, towarzyszy wzrost entropii;
Entropia układu izolowanego dąży do maksimum aż ustali się równowaga termodynamiczna między wszystkimi składnikami tego układu;
W stanie równowagi zmiana entropii równa się zero, a przemiany mają charakter odwracalny.
III zasada termodynamiki:
Entropia maleje wraz z obniżaniem temperatury. W temperaturze zera bezwzględnego 0K entropia czystych ciał krystalicznych, niezależnie od typu kryształu równa się zero.
Ta zasada umożliwia określenie bezwzględnych wartości entropii poszczególnych substancji;
Molowe entropie S0298 odniesione do warunków standardowych podane w tablicach…
... zobacz całą notatkę






Komentarze użytkowników (0)