To tylko jedna z 5 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


STAN RÓWNOWAGI CHEMICZNEJ Równowaga reakcji chemicznej ustala się, gdy reakcja z taką samą szybkością przebiega w jedną i drugą stronę, a więc stężenia reagentów nie zmieniają się w czasie.
Stan równowagi reakcji chemicznej oznacza, że w każdej chwili z substratów tworzy się tyle samo produktów ile z produktów tworzy się substratów. W stanie równowagi chemicznej iloczyn stężeń produktów reakcji podniesionych do odpowiednich potęg podzielony przez iloczyn stężeń substratów reakcji, także podniesionych do odpowiednich potęg, ma wartość stałą w stałej temperaturze.
Dla reakcji:
stała równowagi reakcji wyraża się wzorem:
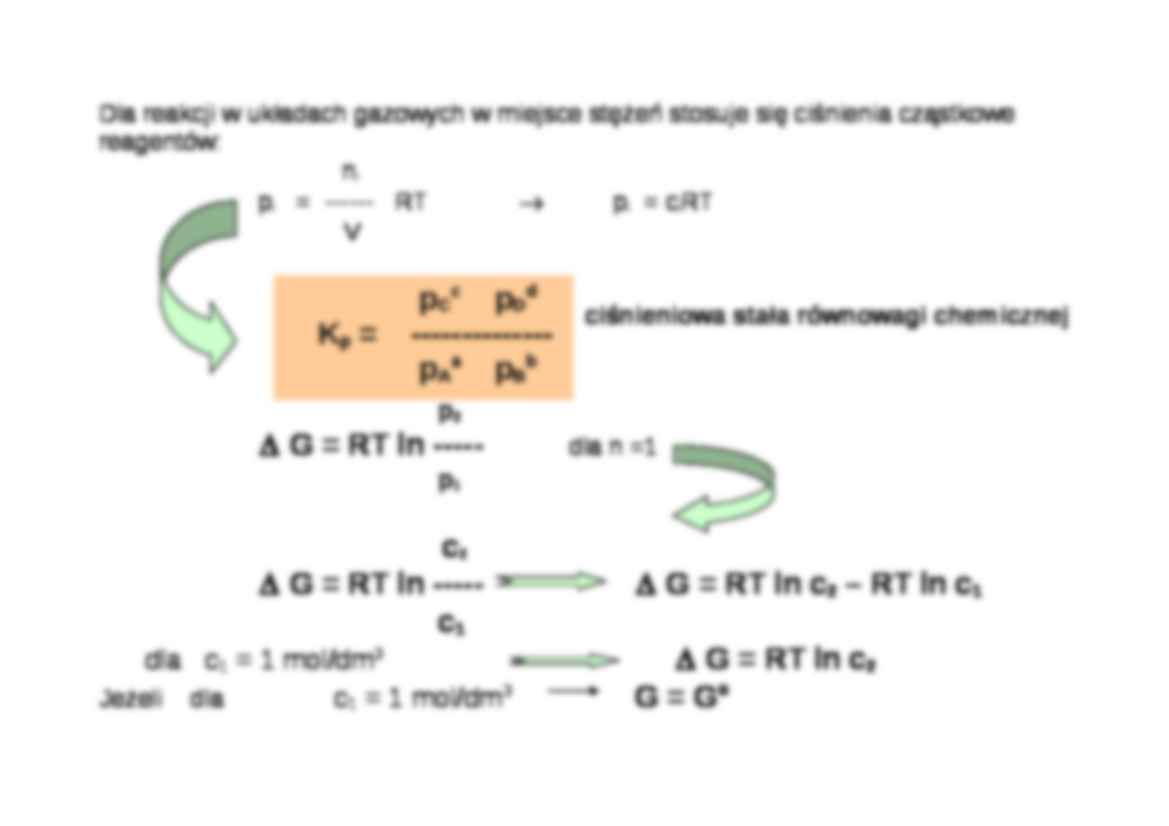
Dla reakcji w układach gazowych w miejsce stężeń stosuje się ciśnienia cząstkowe reagentów: n i p i = ------ RT → p i = c i RT
V ciśnieniowa stała równowagi chemicznej p 2 Δ G = RT ln ----- dla n =1 p 1 c 2 Δ G = RT ln ----- Δ G = RT ln c 2 - RT ln c 1 c 1 dla c 1 = 1 mol/dm 3 Δ G = RT ln c 2 Jeżeli dla c 1 = 1 mol/dm 3 G = G o to entalpia swobodna układu dla dowolnego innego stężenia c : G = G o + RT ln c a dla poszczególnego reagenta i-tego w układzie:
i G i = i G o + RT ln c i Δ G takiej reakcji równa się różnicy pomiędzy sumą entalpii swobodnej produktów i sumą entalpii swobodnej substratów:
K C gdy stężenia odpowiadają stanowi równowagi chemicznej to Δ G = 0 stąd dla T = const
(…)
… podniesionych do odpowiednich potęg podzielony przez iloczyn stężeń substratów reakcji, także podniesionych do odpowiednich potęg, ma wartość stałą w stałej temperaturze.
Dla reakcji:
stała równowagi reakcji wyraża się wzorem:
Dla reakcji w układach gazowych w miejsce stężeń stosuje się ciśnienia cząstkowe reagentów: ni pi = ------ RT → pi = ciRT
V ciśnieniowa stała równowagi chemicznej
p2 Δ G = RT ln ----- dla n =1 p1
c2 Δ G = RT ln ----- Δ G = RT ln c2 - RT ln c1
c1
dla c1 = 1 mol/dm3 Δ G = RT ln c2
Jeżeli dla c1 = 1 mol/dm3 G = Go to entalpia swobodna układu dla dowolnego innego stężenia c : G = Go + RT ln c
a dla poszczególnego reagenta i-tego w układzie:
iGi = iGo + RT ln ci
Δ G takiej reakcji równa się różnicy pomiędzy sumą entalpii swobodnej produktów i sumą entalpii swobodnej substratów:
KC…
... zobacz całą notatkę






Komentarze użytkowników (0)