To tylko jedna z 5 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
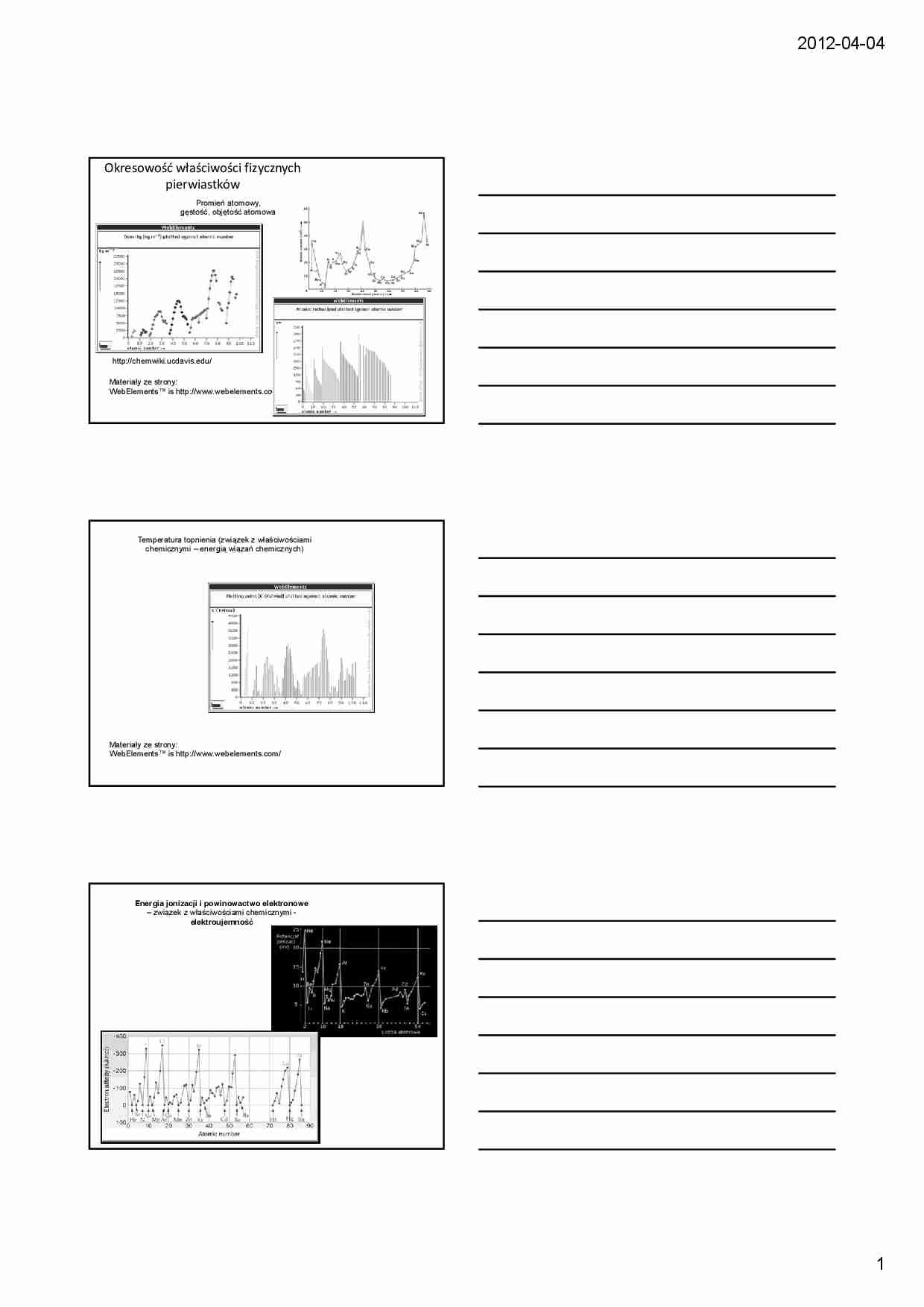


2012-04-04 1 Materiały ze strony: WebElements™ is http://www.webelements.com/ http://chemwiki.ucdavis.edu/ Promień atomowy, gęstość, objętość atomowa Okresowość właściwości fizycznych pierwiastków Materiały ze strony: WebElements™ is http://www.webelements.com/ Temperatura topnienia (związek z właściwościami chemicznymi – energią wiązań chemicznych) Energia jonizacji i powinowactwo elektronowe – związek z właściwościami chemicznymi - elektroujemność 2012-04-04 2 Elektroujemność skala Paulinga Elektroujemność – miara tendencji do przyciągania elektronów przez atomy danego pierwiastka. Linus Pauling (1901-1994) – amerykański fizyk i chemik. Dwukrotny laureat Nagrody Nobla Stosowane skale elektroujemności. 1. Skala Paulinga 2. Skala Allreda-Rochowa 3. Skala Mullikena Uwaga: elektroujemność pierwiastków zależy w pewnym stopniu od ich stopnia utlenienia, hybrydyzacji struktury cząsteczki. Zdarza się, że wiązania są spolaryzowane odwrotnie niż wynikałoby to z formalnej różnicy elektroujemności. Skala elektroujemności Mullikena obejmuje zależność od stopnia ultnienia Elektroujemność w skali Paulinga dla pierwiastków w układzie okresowym Trójkąt van Arkel-Ketelaara Zależność rodzaju wiązań od elektroujemności atomów. Podział pierwiastków na metale, niemetale i półmetale (metaloidy) oraz gazy szlachetne 2012-04-04 3 Metale Metale – pierwiastki chemiczne charakteryzujące się obecnością w sieci krystalicznej elektronów swobodnych (niezwiązanych), niską energią jonizacji, niskim powinowactwem elektronowym i niską elektroujemnością. Właściwości fizyczne: - bardzo dobre przewodnictwo elektryczne - stan skupienia stały (z wyjątkiem rtęć) - wysoka temperatura topnienia, - błyszcząca, gładka powierzchnia, - kolor srebrzystoszary (z wyjątkiem miedzi i złota) - ciągliwość i kowalność, - dobre przewodnictwo cieplne, - szybkie wypromieniowywanie ciepła, Właściwości chemiczne: - niska elektroujemność - tworzą między sobą wiązania metaliczne, - tworzą związki chemiczne o właściwościach zasadowych i nukleofilowych - skłonność do tworzenia jonów dodatnich (kationów) Podział metali: * metale alkaliczne grupa I * metale ziem alkalicznych grupa II * metale przejściowe blok d * metale ziem rzadkich. blok f Niemetale Niemetale – pierwiastki chemiczne charakteryzujące się wysoką elektroujemnością i wysokim powinowactwem elektronowym Właściwości fizyczne: - stan skupienia gazowy (cząsteczki dwuatomowe), ciekły, lub stały (kryształy molekularne lub kryształy kowalencyjne) - bardzo złe przewodnictwo elektryczne - izolatory
(…)
…
(kryształy molekularne lub kryształy kowalencyjne)
- bardzo złe przewodnictwo elektryczne - izolatory
Właściwości chemiczne:
- wysoka elektroujemność
- między sobą tworzą wiązania kowalencyjne lub kowalencyjne
spolaryzowane,
- tworzą związki chemiczne o właściwościach
kwasowych i elektrofilowych
- skłonność do tworzenia jonów ujemnych (anionów) w związkach z
metalami
Cząsteczki niemetali:
Cząsteczki…
… kryształów substancji organicznych, np. glukoza,
cukier buraczany/trzcinowy – sacharoza.
Właściwości: niska twardość i temperatury topnienia, są izolatorami
Niemetale grupy IV (14) i ich związki
z niemetalami grup 13 i 15 kryształy kowalencyjne
Przykłady:
Diament,
Krzem
Węglik krzemu,
Azotek węgla
Azotek krzemu
Kryształy kowalencyjne – kryształy zbudowane z atomów połączonych
wiązaniami kowalencyjnymi…
... zobacz całą notatkę






Komentarze użytkowników (0)