To tylko jedna z 22 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


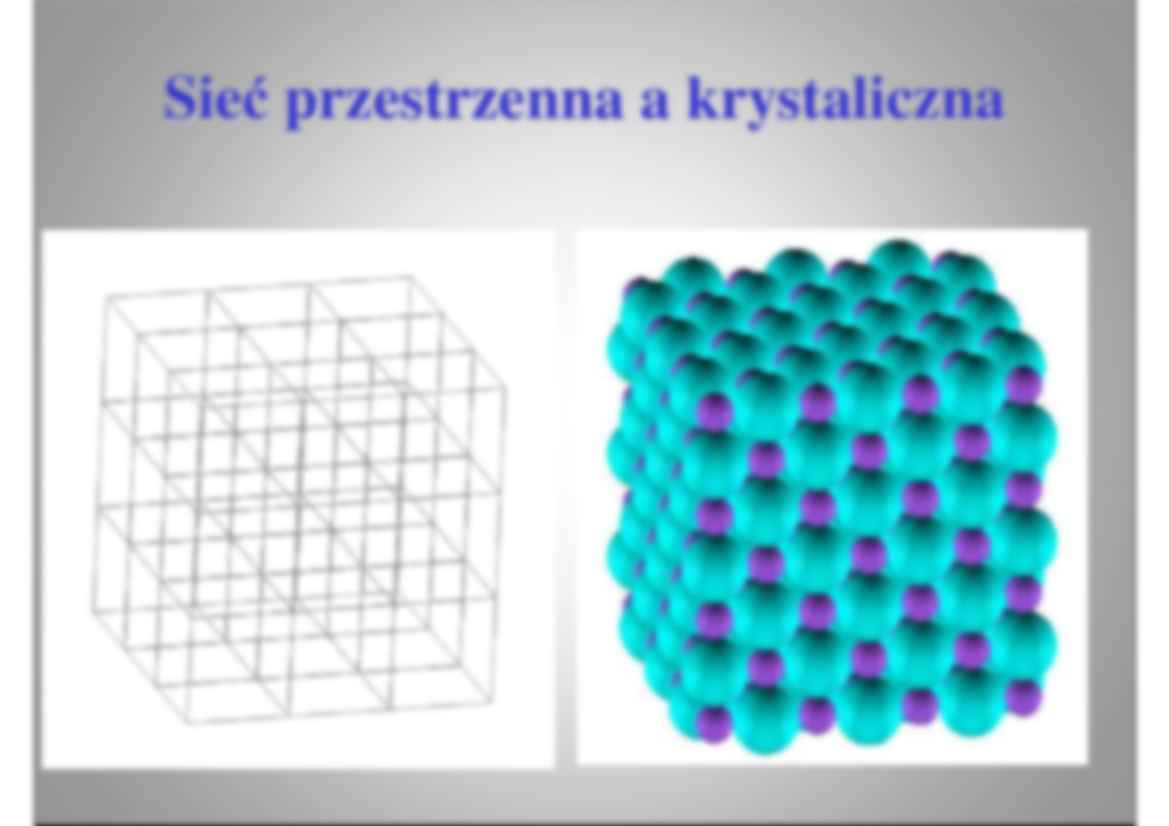
Wyk Wy ład 9 ad Wprowadzenie do krystalochemii Wprowadzenie do krystalochemi 1. Krystalografia a krystalochemia. 2. Prawa krystalochemii 3. Sie ć krystaliczna i pozycje atomów 4. Bliskie i dalekie uporz ą dkowanie. 5. Kryształ a cz ą steczka. 6. Wi ą zanie w kryształach. Czym zajmuje si Czym zajmuje s ę krystalochemia oparta krystalochemia oparta na krystalografii strukturalnej ? na krystalografii strukturalnej 1. Wi ą zanie chemiczne w kryształach. 2. Podział i porównywalno ść struktur krystalicznych. 3. Przemiany fazowe, procesy krystalizacji i wzrostu kryształów. Zale Ŝ no ś ci ą mi ę dzy składem chemicznym a struktur ą kryształu. Sie Si ć przestrzenna a krystaliczna przestrzenna a krystaliczn Struktury odmian alotropowych w Struktury odmian alotropowych ę gla gl diament grafit fuleren C 60 Struktury odmian Struktury odmian polimorficznych SiO2 polimorficznych SiO krystobalit trydymit kwarc Prawa Krystalochemii (Goldschmidt Prawa Krystalochemii (Goldschmid -1926) 1926 1. Budowa kryształu jest uwarunkowana przez stosunek ilo ś ci, stosunek wielko ś ci i przez stan polaryzacji elementów budowy kryształu tj. atomów, jonów oraz grup atomów (jony kompleksowe, rodniki, cz ą steczki). 2. Ró Ŝ ne struktury kryształów mo Ŝ na poł ą czy ć w jedn ą grup ę struktur porównywalnych, je Ŝ eli atomy w nich wyst ę puj ą ce znajduj ą si ę w takim samym stanie: atomowym, jonowym lub metalicznym. 3. Je Ŝ eli atomy z których s ą zbudowane kryształy znajduj ą si ę w ró Ŝ nych stanach, to typy struktur krystalicznych nale Ŝą do grup nieporównywalnych. Rodzaje struktur krystalicznych Rodzaje struktur krystalicznyc ◄ kowalencyjny metaliczny jonowy molekularny ► kryształy kowalencyjne charakteryzują się występowaniem „czystego” wiązania kowalencyjnego pomiędzy wszystkimi atomami tworzącymi sieć krystaliczną. Kryształ kowalencyjny moŜna traktować jako jedną gigantyczną molekułę, charakteryzują się wysokimi temperaturami topienia i wysoką twardością, przykładem takiej struktury jest diament. kryształy jonowe zbudowane są atomów obdarzonych ładunkiem elektrostatycznym (jonów) spajanych w sieć kryształu poprzez oddziaływania kulombowskie. Kryształy jonowe maja zwykle wysokie temperatury topienia, są rozpuszczalne w roztworach wodnych (rozpuszczalnikach polarnych) a ich typowym przykładem są kryształy NaCl
(…)
… Wykład 9
Wprowadzenie do krystalochemii
1. Krystalografia a krystalochemia.
2. Prawa krystalochemii
3. Sieć krystaliczna i pozycje atomów
4. Bliskie i dalekie uporządkowanie.
5. Kryształ a cząsteczka.
6. Wiązanie w kryształach.
Czym zajmuje się krystalochemia oparta
na krystalografii strukturalnej ?
ZaleŜnością między składem chemicznym a
strukturą kryształu.
1. Wiązanie chemiczne w kryształach…
…
Delokalizacja
Metaliczne
Polaryzacja
Jonowe
Elektroujemność wg Paulinga
Elektroujemność jest to właściwość atomu w
wiązaniu chemicznym określona jako siła
atrakcji elektronu przez atom tworzący wiązanie
(dokładnie „power of an atom in a molecule to
attract electrons to itself”)
Elektroujemność pierwiastków
Względna elektroujemność pierwiastków wg Paulinga
H – 2.1
Li – 1.0
Na– 0.9
K – 0.8
Rb– 0.8
Cs - 0.7
Be…
… metaliczne tworzą sieć zbudowaną z węzłów obsadzonych, dodatnio
naładowanymi atomami pierwiastków metalicznych (kationów), których elektrony
walencyjne są na tyle swobodne, Ŝe mogą wypełniać przestrzeń między nimi („gaz
elektronowy”). Metale charakteryzują się gęstym upakowaniem (wysoka gęstość),
plastycznością i przewodnictwem elektrycznym np. miedź, srebro.
kryształy molekularne jako elementy…
… - jonowe (spolaryzowane) np. SiO2,
AlCl3,
3. jonowe np. NaCl, KBr. CaO,
4. metaliczne np. Ag, Zn i stopy metali,
5. dyspersyjne np. zestalone gazy szlachetne.
Heterodesmiczne
1. kowalencyjne i dyspersyjne (kryształy molekularne)
2. kowalencyjne i kowalencyjne spolaryzowane
3. kowalencyjne i jonowe
4. kowalencyjne i metaliczne
5. jonowe i kowalencyjne spolaryzowane
Charakter wiązań w krysztale
Kowalencyjne…
... zobacz całą notatkę






Komentarze użytkowników (0)