To tylko jedna z 22 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


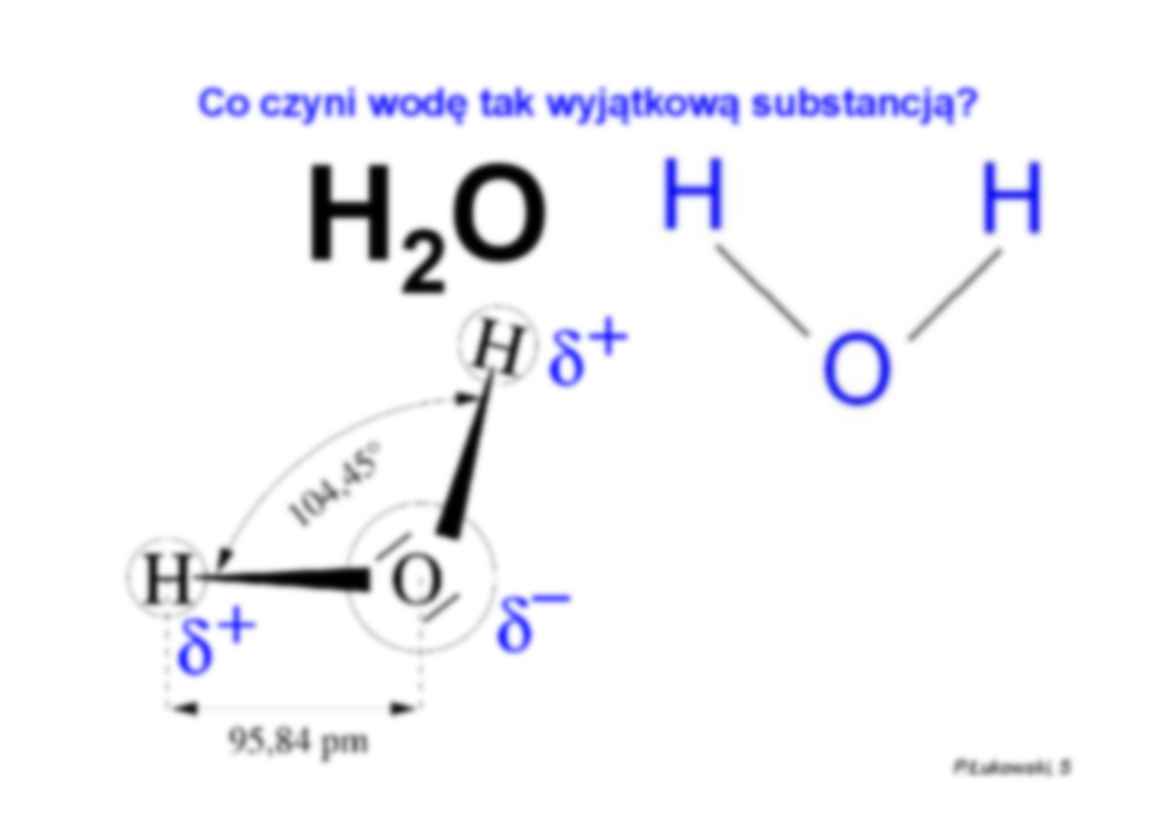
WODA P.Łukowski, 4 Światowe zużycie roczne niektórych materiałów Stal Drewno Beton Żywność przemysł ∼ 300 mld t budownictwo ∼ 100 mld t ∼ 1 % bezpowrotnie ! 1,3 mld t 3,5 mld t 10 mld t 1500 mld t Woda 2300 mld t Oszczędzajmy wodę – także (zwłaszcza!) budując! H 2O Co czyni wodę tak wyjątkową substancją? P.Łukowski, 5 P.Łukowski, 6 Co czyni wodę tak wyjątkową substancją? E wiązania wodorowego E wiązania Van der Waalsa Przemiana fazowa wody Trzeba dostarczyć znacznie więcej energii, żeby doprowadzić do przemiany fazowej wody, niż w przypadku innych cieczy Temperatura topnienia i wrzenia wody jest znacznie wyższa, niż innych cieczy o podobnej masie cząsteczkowej P.Łukowski, 8 P.Łukowski, 9 Gdyby cząsteczka wody miała budowę liniową... H 2S H 2O H 2O ?? T wrz = 100 ° C T wrz = -61 ° C T wrz = -80 ° C Dysocjacja elektrolityczna wody 2H 2O ⇔ H3O + + OH– H 2O ⇔ H + + OH– 16 10 8 , 1 2 − ⋅ = ⋅ = − + O H OH H c c c c K dysocjacja ≡ rozpad dysocjacja elektrolityczna ≡ rozpad na jony pod wpływem elektrolitu Stała dysocjacji (elektrolitycznej) wody: P.Łukowski, 11 H 2O ⇔ H + + OH– 16 10 8 , 1 2 − ⋅ = ⋅ = − + O H OH H c c c c K ≅ const = ⋅ = − + OH H I c c K Iloczyn jonowy wody: ? Czyli jakie jest stężenie molowe wody w wodzie ? ☺ V n c = ρ H2O = 1000 g/dm 3 M H2O = 18 g/mol 1 dm3 wody zawiera 1000/18 = 55,56 moli wody, czyli 3 56 , 55 2 dm mol c O H = O H c c K 2 ⋅ = P.Łukowski, 12 14 16 10 56 , 55 10 8 , 1 2 − − ≅ ⋅ ⋅ = ⋅ = ⋅ = − + O H c OH H I c K c c K const c c K OH H I = = ⋅ = − − + 14 10 c H+ ↑ ⇒ cOH- ↓ c H+ ↓ ⇒ cOH- ↑ Czyli w roztworach wodnych: P.Łukowski, 13 Odczyn wody / roztworu wodnego W czystej chemicznie wodzie c H+ = cOH- K I = 10 -14 ⇒ c H+ = cOH- = √KI = 10 -7 mol/dm3 K I = const także w roztworach wodnych, zatem: W roztworach kwaśnych c H+ cOH- (odczyn kwaśny) c H+ 10 -7 mol/dm3 a c OH- 10 -7 mol/dm3 W roztworach obojętnych c H+ = cOH- = 10 -7 mol/dm3 (odczyn neutralny) P.Łukowski, 14 Wykładnik jonów wodorowych, pH
(…)
… zasad:
NaCl + H2O ⇔
NIE !
P.Łukowski, 25
Najważniejsze reakcje chemiczne z udziałem wody
Hydratacja = przyłączenie cząsteczek wody
CaSO4 + 2H2O ⇒ CaSO4 ⋅ 2H2O
woda krystalizacyjna
CaO + H2O ⇒ Ca(OH)2
to też hydratacja!
woda konstytucyjna
Dehydratacja = reakcja odwrotna do hydratacji
(odłączenie cząsteczek wody)
CaSO4 ⋅ 2H2O ⇒ CaSO4 + 2H2O
P.Łukowski, 26
Klasyfikacja wody do celów budowlanych
wg PN-EN…
... zobacz całą notatkę






Komentarze użytkowników (0)