To tylko jedna z 20 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

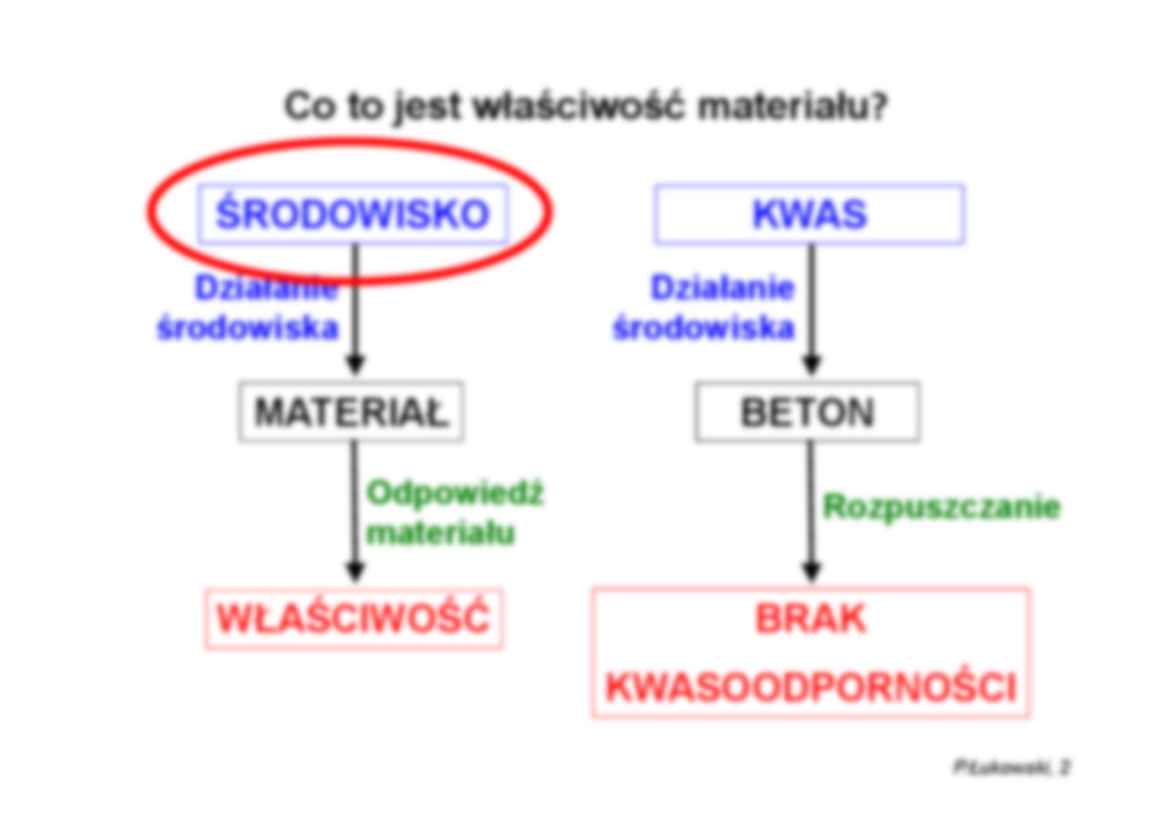

STANY SKUPIENIA MATERII Stan gazowy i ciekły MATERIAŁ Działanie środowiska Odpowiedź materiału WŁAŚCIWOŚĆ ŚRODOWISKO Co to jest właściwość materiału? BETON Działanie środowiska Rozpuszczanie BRAK KWASOODPORNOŚCI KWAS P.Łukowski, 2 P.Łukowski, 3 Ile znamy stanów skupienia materii? - kryształ - kryształ plastyczny - kryształ condis - ciało amorficzne - ciekły kryształ - ciecz izotropowa - faza nadciekła - ciecz nadkrytyczna - gaz - plazma - plazma neutronowa - plazma kwarkowa (stan hipotetyczny) - ... ? P.Łukowski, 4 W praktyce budowlanej występują trzy tradycyjne stany skupienia: - gazy, - ciecze, - ciała stałe. GAZ CIECZ skraplanie parowanie CIAŁO STAŁE krzepnięcie topnienie resublimacja sublimacja Charakterystyka stanów skupienia materii Cecha Gaz Ciecz Ciało stałe Zmiana kształtu + + - Zmiana objętości + - - Uporządkowanie struktury wewnętrznej Brak Częściowe, lokalne, chwilowe Całkowite lub prawie całkowite Defekty struktury wewnętrznej Całkowite zdeformowanie Bardzo liczne Nieliczne Odległości między cząsteczkami Bardzo duże Duże Małe Siła wiązań międzycząsteczkowych Bardzo mała Średnia Duża Przestrzenne ukierunkowanie właściwości Izotropowe ± Izotropowe Anizotropowe P.Łukowski, 5 P.Łukowski, 6 Stan gazowy Gaz doskonały: - cząsteczki to punkty materialne o zerowej objętości, - całkowity brak oddziaływań międzycząsteczkowych, - zderzenia cząsteczek są doskonale sprężyste. Prawo Boyle’a-Mariotta: pV = const (przemiana izotermiczna, T = const) czyli p ↑⇔ V ↓ , p ↓⇔ V ↑ Prawa stanu gazowego (dla gazu doskonałego) Prawo Charlesa: V/T = const (przemiana izobaryczna, p = const) czyli V ↑⇔ T ↑ , V ↓⇔ T ↓ Prawo Amontona: p/T = const (przemiana izochoryczna, V = const) czyli p ↑⇔ T ↑ , p ↓⇔ T ↓ P.Łukowski, 7 Prawo Avogadra: w warunkach normalnych (p = 0,1 MPa, T = 273 K) 1 mol (tj. 6,023⋅1023 cząsteczek lub atomów) gazu zajmuje objętość ok. 22,4 dm3 Prawa stanu gazowego (dla gazu doskonałego) Równanie stanu gazowego: pV = nRT n – liczba moli gazu, R – stała gazowa P.Łukowski, 8 P.Łukowski, 9 Równanie stanu gazu rzeczywistego (Van der Waalsa) poprawka na ciśnienie wewnętrzne (oddziaływania międzycząsteczkowe) poprawka na objętość cząsteczek P.Łukowski, 10 Siły spójności cieczy Rodzaj cieczy Wiązania I rzędu Wiązania II rzędu Przykład Ciecze
(…)
…
rozpuszczonej jest na poziomie cząsteczkowym (< 1 nm).
Etapy rozpuszczania ciała stałego w cieczy:
- niszczenie sieci krystalicznej
- solwatacja (w przypadku wody – hydratacja)
- dyfuzja cząstek rozpuszczonych (cząsteczek, jonów) w
głąb fazy ciekłej
P.Łukowski, 15
Krystalizacja
Krystalizacja to proces odwrotny do rozpuszczania.
Etapy krystalizacji:
- powstawanie zarodków krystalizacji
- wzrost kryształu…
… w budownictwie!
• Wapno gaszone Ca(OH)2
• Gips półwodny CaSO4⋅½H2O i dwuwodny CaSO4⋅2H2O,
anhydryt CaSO4
P.Łukowski, 18
Rozpuszczalność ciał stałych w cieczach
Roztwór nasycony ≡ roztwór będący w równowadze z
substancją rozpuszczaną (po dodaniu kolejnej porcji
substancji rozpuszczanej pozostanie ona nierozpuszczona).
Jeśli w trakcie rozpuszczania zachodzi
AB ⇔ A+ + Bto iloczyn rozpuszczalności L = cA+ ⋅ cBW…
... zobacz całą notatkę






Komentarze użytkowników (0)