To tylko jedna z 16 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Homojądrowe
cząsteczki dwuatomowe
Cząsteczki dwuatomowe
w drugim okresie
Pierwiastki drugiego okresu
Konfiguracja elektronowa w stanie podstawowym:
Li
Be
B
C
N
O
F
Ne
K2s1
K2s2
K2s22p1
K2s22p2
K2s22p3
K2s22p4
K2s22p5
K2s22p6
K = 1s2 (He)
1
Orbitale walencyjne drugiego okresu;
moŜliwość tworzenia kombinacji liniowej,
mającej sens wiązania chemicznego
Atom A
-
+
x
-
+
σ*2px
π*2py
π*2pz
Atom B
-
+
2p
x
+
y
z
x
-
z
π2pz
2p
x
y
π2py
σ2px
σ*2s
-
+
-
+
x
2s
2s
σ2s
+
x
Cząsteczka Li2
Li2 KKσ2s2
K2s1
Li
π*2p
Li
K2s1
y
2p
x
σ*2p
π*2p
2p
x
y
z
π2p
z
π2p
σ2p
σ*2s
2s
2s
σ2s
2
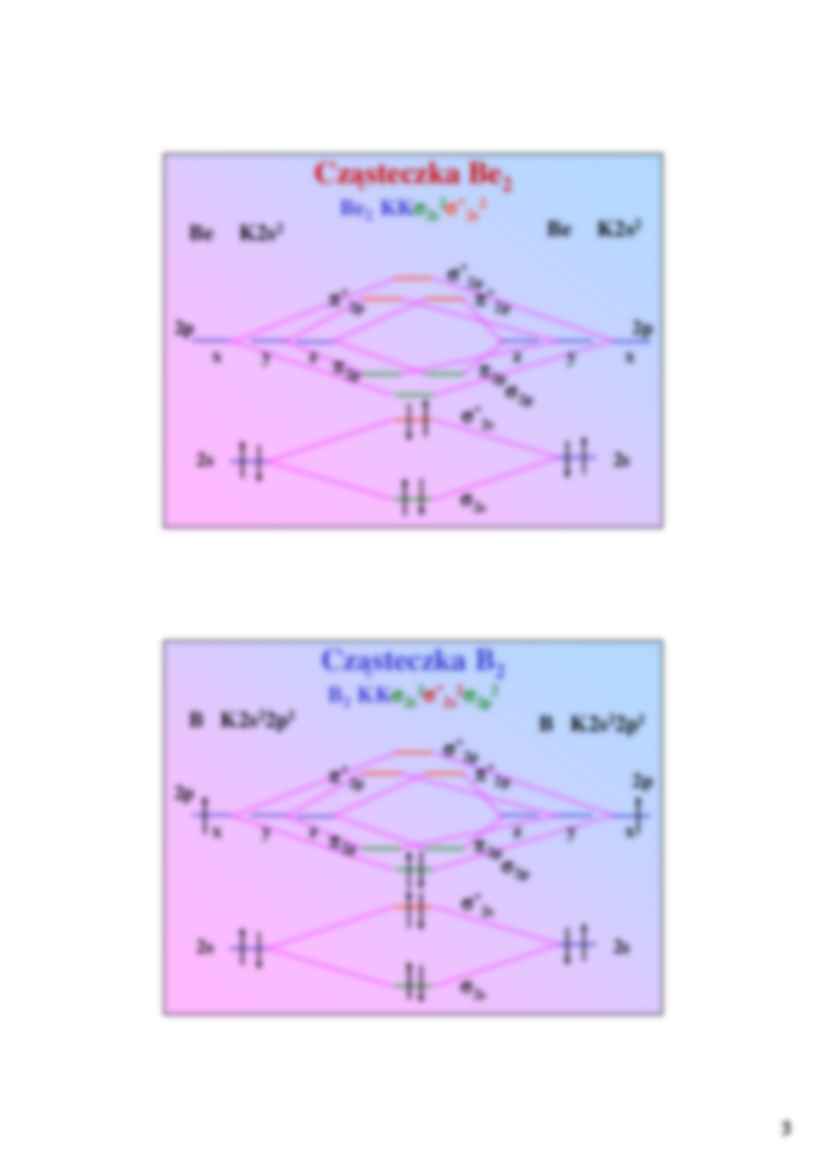
Cząsteczka Be2
Be
Be2 KKσ2s2σ*2s2
K2s2
π*2p
Be
σ*2p
π*2p
2p
x
y
z
π2p
K2s2
z
π2p
σ2p
y
2p
x
σ*2s
2s
2s
σ2s
Cząsteczka B2
B2 KKσ2s2σ*2s2σ2p2
B K2s22p1
B K2s22p1
π*2p
2p
x
y
z
π2p
σ*2p
π*2p
2p
z
π2p
σ2p
y
x
σ*2s
2s
2s
σ2s
3
Cząsteczka C2
C2 KKσ2s2σ*2s2σ2p2π2p1π2p1
C K2s22p2
C K2s22p2
π*2p
2p
x
y
z
π2p
σ*2p
π*2p
2p
z
π2p
σ2p
y
x
σ*2s
2s
2s
σ2s
Cząsteczka N2
N2 KKσ2s2σ*2s2σ2p2π2p2π2p2
N K2s22p3
N K2s22p3
π*2p
2p
x
y
z
π2p
σ*2p
π*2p
2p
z
π2p
σ2p
y
x
σ*2s
2s
2s
σ2s
4
Cząsteczka O2
O2 KKσ2s2σ*2s2σ2p2π2p2π2p2π*2p1π*2p1
O K2s22p4
O K2s22p4
σ*2p
π*2p
π*2p
2p
2p
x
y
z
π2p
z
π2p
σ2p
y
x
σ*2s
2s
2s
σ2s
Cząsteczka F2
F2 KKσ2s2σ*2s2σ2p2π2p2π2p2π*2p2π*2p2
F K2s22p5
F K2s22p5
σ*2p
π*2p
π*2p
2p
2p
x
y
z
π2p
z
π2p
σ2p
y
x
σ*2s
2s
2s
σ2s
5
Cząsteczka Ne2
Ne2 KKσ2s2σ*2s2σ2p2π2p2π2p2π*2p2π*2p2σ*2p2
Ne K2s22p6
Ne K2s22p6
σ*2p
π*2p
π*2p
2p
2p
x
y
z
π2p
z
y
π2p
σ2p
x
σ*2s
2s
2s
σ2s
Pary wiąŜące i antywiąŜące
X2 Ne Konfiguracja
P.W.
Ew
d[pm]
[kJ/mol]
Li2 2 σs2
Be2 4 σs2σ*s2
1
-104
267
1-1=0
-
-
B2
6 σs2σ*s2σp2
2-1=1
-288
159
C2
8 σs2σ*s2σp2πy1πz1
3-1=2
-599
124
N2 10 σs2σ*s2σp2πy2πz2
4-1=3
-941
110
O2 12 σs2σ*s2σp2πy2πz2π*y1π*z1
4-2=2
-493
121
F2 14 σs2σ*s2σp2πy2πz2π*y2π*z2
4-3=1
-156
142
-
-
Ne2 16 σs2σ*s2σp2πy2πz2π*y2π*z2σ*s2 4-4=0
6
Liczba elektronów a długość wiązania
Wzór Ne
O22-
P.W. d[pm] Przykład
Nazwa
14
1
149
Na2O2
jon nadtlenkowy
O21-
13
1,5
126
KO2
jon ponadtlenkowy
O2
12
2
121
O2
Tlen
2,5
112
O21+ 11
O2[PtF6] jon oksygenylowy
Wzrost lub zmniejszenie liczby elektronów na
orbitalach antywiąŜących powoduje zmianę
długości i energii wiązania
Wiązanie chemiczne jako para elektronów
Co oznaczają "zwykłe" zapisy wiązań jako kresek
pomiędzy symbolami atomów ? (Lewis)
Li − Li, C = C, N ≡ N, O = O, F − F , ..
... liczbę wiązań per saldo (liczbę par wiąŜących
po odjęciu liczby par antywiąŜących)
7
Heterojądrowe
cząsteczki dwuatomowe
Cząsteczki dwuatomowe
Heterojądrowe cząsteczki dwuatomowe
• ... kolejność energii orbitali we wszystkich
atomach wieloelektronowych jest taka sama, ale
taki sam orbital (n,l) w róŜnych atomach ma
róŜne energie ...
E1s
(…)
… - xB
RóŜnica elektroujemności pierwiastków tworzących
wiązanie określa jego charakter
Charakter wiązania
∗ N2 3,0 - 3,0 = 0
wiązanie kowalencyjne
∗ CsF 4,0 - 0,7 = 3,3 wiązanie jonowe
∗ NO 3,5 - 3,0 = 0,5 wiązanie atomowe
spolaryzowane
∗ HCl 3,2 -2,2 = 1,0 wiązanie atomowe
spolaryzowane
∗ H2O 3,5 -2,2 = 1,3 wiązania atomowe
spolaryzowane
15
Własności kierunkowe wiązań
2Py
2P x
O
1s
1s
H
H
Cząsteczka…
… !
Gęstość elektronowa w cząsteczce
heterojądrowej
HF (K F 2s F 2σ HF 2 2p y,F 2 2p z,F 2 )
F K2s22p5
σ*HF
H 1s1
1s
3,8 eV
2p
σHF
2s
2sF
F
H
¶ * (-)
11
Przesunięcie ładunku wiązania
A+δ B-δ δ - wielkość przemieszczonego
ładunku (moŜe być mniej niŜ e );
δ=0
ładunek jest symetryczny wiązanie ma charakter kowalencyjny;
δ=e
przeniesienie ładunku (elektronu) od
A do B, wiązanie jonowe
Moment dipolowy
-*
+*
µ…
... zobacz całą notatkę






Komentarze użytkowników (0)