To tylko jedna z 4 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
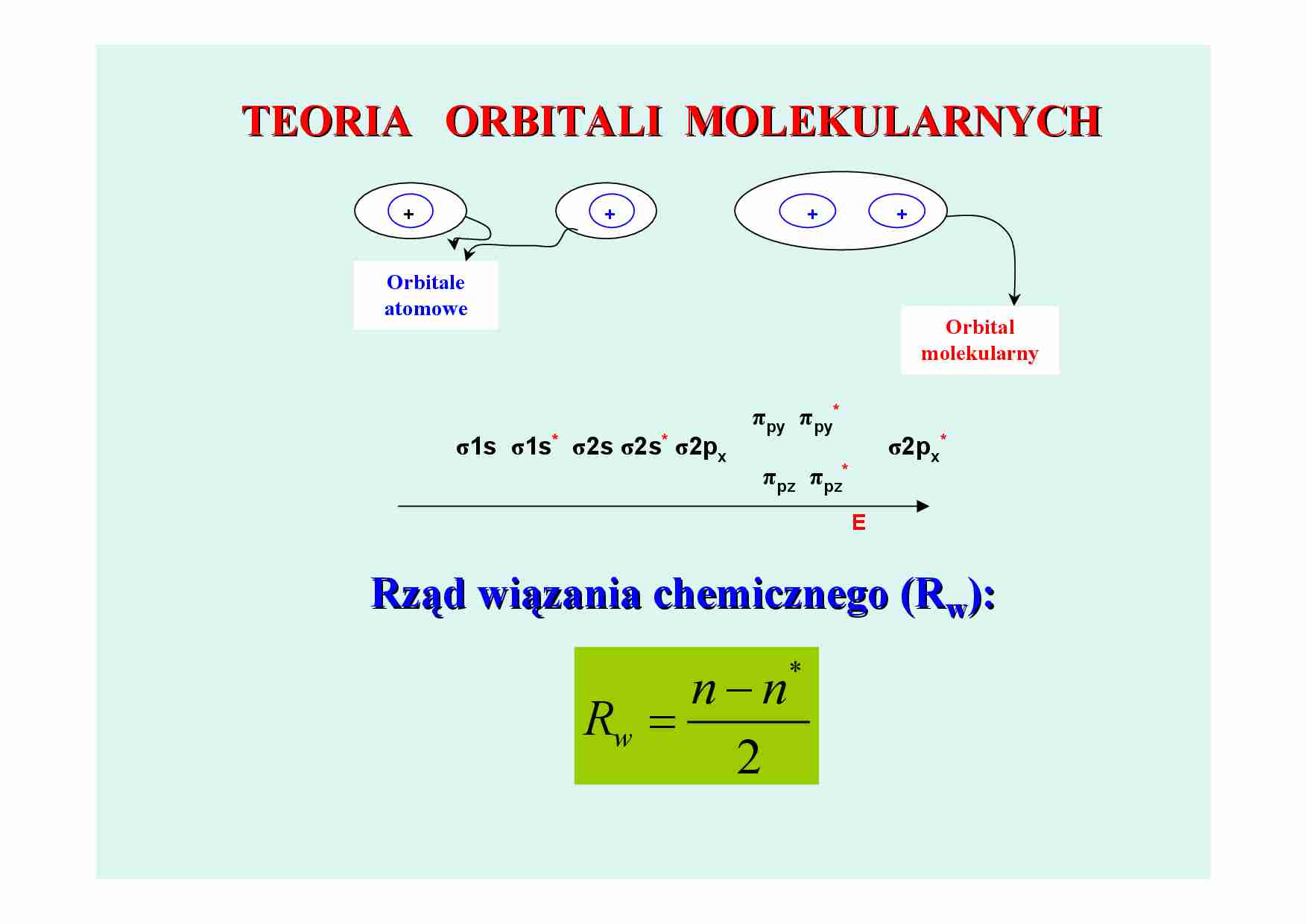
TEORIA ORBITALI MOLEKULARNYCH
+
+
+
+
Orbitale
atomowe
Orbital
molekularny
σ1s σ1s* σ2s σ2s* σ2px
πpy πpy*
σ2px*
πpz πpz*
E
Rząd wiązania chemicznego (Rw):
n−n
Rw =
2
*
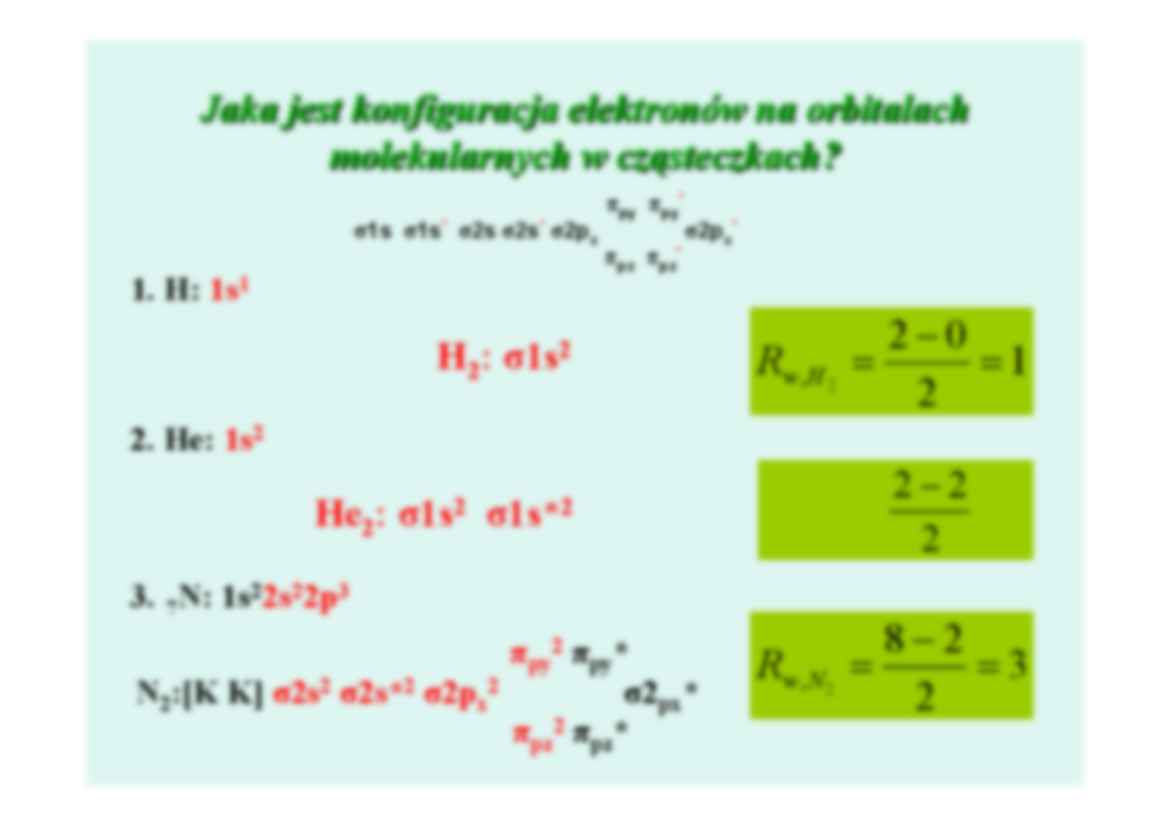
Jaka jest konfiguracja elektronów na orbitalach
molekularnych w cząsteczkach?
σ1s σ1s* σ2s σ2s* σ2px
1. H: 1s1
H2:
πpy πpy*
πpz πpz*
σ2px*
σ1s2
Rw,H 2
2−0
=
=1
2
Rw,He2
2−2
=
=0
2
Rw, N 2
8−2
=
=3
2
2. He: 1s2
He2:
σ1s2
σ1s*2
3. 7N: 1s22s22p3
N2:[K K]
σ2s2
σ2s*2
σ2px
2
πpy2 πpy*
σ2px*
πpz2 πpz*
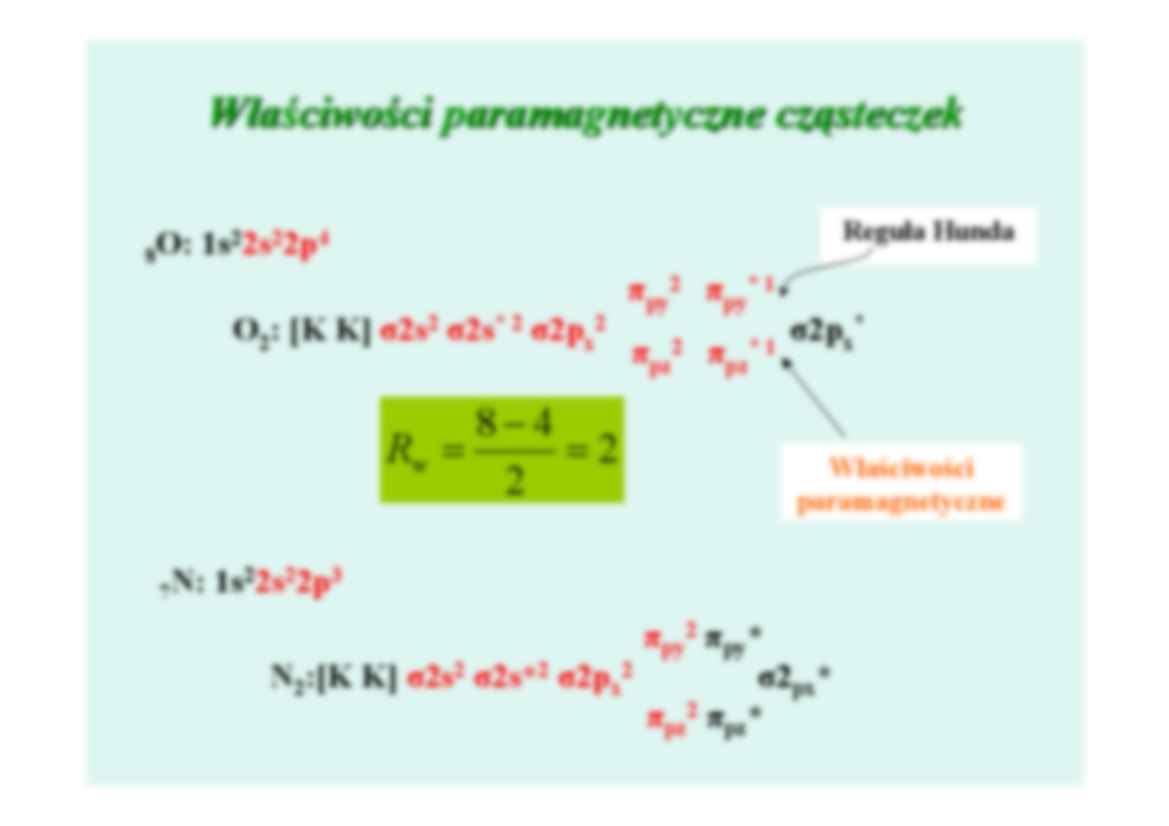
Właściwości paramagnetyczne cząsteczek
Reguła Hunda
2 2
4
8O: 1s 2s 2p
O2: [K K] σ2s2 σ2s* 2 σ2px2
πpy2 πpy* 1
πpz2 πpz* 1
8−4
Rw =
=2
2
σ2px*
Właściwości
paramagnetyczne
N: 1s22s22p3
7
N2:[K K] σ2s2 σ2s*2 σ2px2
πpy2 πpy*
σ2px*
πpz2 πpz*
Długość wiązania chemicznego jest tym większa im większa
jest wartość Rw
O22–
O2–
O2
O2+
Liczba elektronów na
orbitalach molekularnych
18
17
16
15
Rw
1
1,5
2
2,5
Długość wiązania w nm
0,149
0,126
0,121
0,112
8O:
1s22s22p4
πpy2 πpy*2
O22– : [K K] σ2s2 σ2s*2 σ2px2
O2– : [K K] σ2s2 σ2s*2 σ2px2
πpz2 πpz*2
πpy2 πpy*2
πpz2 πpz*1
O2+ : [K K] σ2s2 σ2s*2 σ2px2
Rw,O 2− =
σ2px*
Rw,O − =
8−5
= 1,5
2
Rw,O+ =
8−3
= 2,5
2
πpy2 πpy*1
πpz2 πpz*
8−6
=1
2
σ2px*
σ2px*
2
2
2
... zobacz całą notatkę






Komentarze użytkowników (0)