To tylko jedna z 30 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
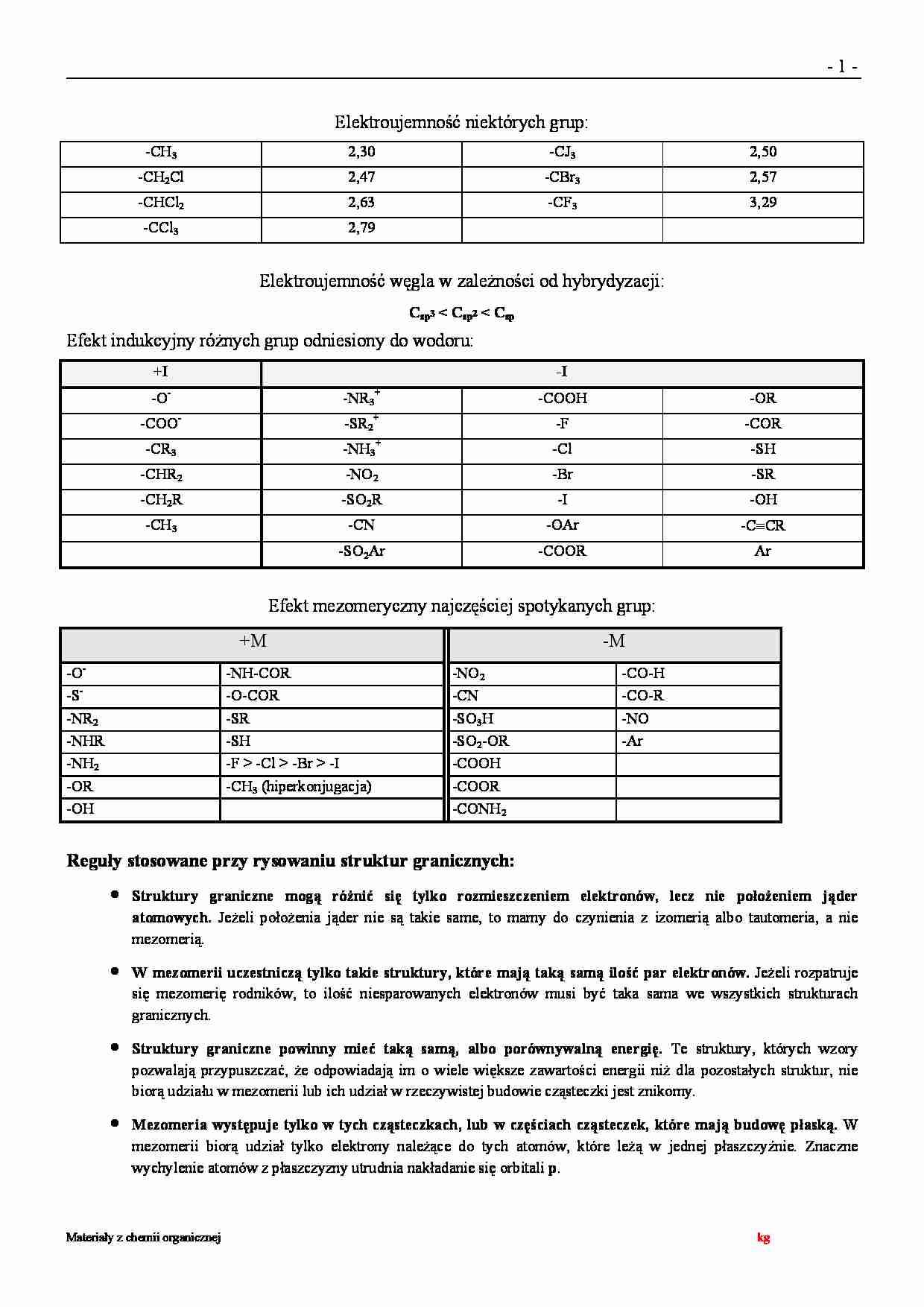


-1Elektroujemność niektórych grup:
-CH3
2,30
-CJ3
2,50
-CH2Cl
2,47
-CBr3
2,57
-CHCl2
2,63
-CF3
3,29
-CCl3
2,79
Elektroujemność węgla w zależności od hybrydyzacji:
Csp3 -Cl -Br -I
-CH3 (hiperkonjugacja)
-M
-NO2
-CN
-SO3H
-SO2-OR
-COOH
-COOR
-CONH2
-CO-H
-CO-R
-NO
-Ar
Reguły stosowane przy rysowaniu struktur granicznych:
•
•
•
•
Struktury graniczne mogą różnić się tylko rozmieszczeniem elektronów, lecz nie położeniem jąder
atomowych. Jeżeli położenia jąder nie są takie same, to mamy do czynienia z izomerią albo tautomeria, a nie
mezomerią.
W mezomerii uczestniczą tylko takie struktury, które mają taką samą ilość par elektronów. Jeżeli rozpatruje
się mezomerię rodników, to ilość niesparowanych elektronów musi być taka sama we wszystkich strukturach
granicznych.
Struktury graniczne powinny mieć taką samą, albo porównywalną energię. Te struktury, których wzory
pozwalają przypuszczać, że odpowiadają im o wiele większe zawartości energii niż dla pozostałych struktur, nie
biorą udziału w mezomerii lub ich udział w rzeczywistej budowie cząsteczki jest znikomy.
Mezomeria występuje tylko w tych cząsteczkach, lub w częściach cząsteczek, które mają budowę płaską. W
mezomerii biorą udział tylko elektrony należące do tych atomów, które leżą w jednej płaszczyźnie. Znaczne
wychylenie atomów z płaszczyzny utrudnia nakładanie się orbitali p.
Materiały z chemii organicznej
kg
-2Gdy dwa atomy różniące się elektroujemnością połączone są wiązaniem π, atom o większej elektroujemności może ściągnąć do
siebie ruchliwe elektrony π:
+
O
-
O
Wolna para elektronowa atomu związanego wiązaniem σ z innym atomem o hybrydyzacji sp lub sp2 jest zdelokalizowana:
-
Cl
Cl
+
O
R
O -
N+
R
N +
O -
O
Wiązania π rozdzielone jednym wiązaniem σ są ze sobą sprzężone i ulegają delokalizacji:
N
+ O
+
-
N
O
+
+
O
-
O
O
-
-
O
W chemii organicznej zdecydowana większość reakcji przebiega z udziałem atomu węgla (na atomie węgla). Pojęcie
kwasów i zasad wg Bröensteda, Lewisa czy Pearsona nie było zbyt dogodne, ponieważ w żaden sposób moc zasad (kwasów) nie
przekładała się na szybkość reakcji. Wprowadzono więc podział substancji reagujących na nukleofile i elektrofile.
Nukleofilem - nazywa się jony ujemne, cząsteczki obojętne, które dysponują wolnymi parami elektronów i podczas reakcji
ze związkami organicznymi atakują te atomy węgla, przy których występuje zmniejszona gęstość elektronów. Odczynniki
nukleofilowe są zasadami zarówno według definicji Bröensteda, jak i Lewisa.
Elektrofilem - nazywa się jony dodatnie i obojętne cząsteczki, które są zdolne do przyłączenia pary elektronów i podczas
reakcji
... zobacz całą notatkę






Komentarze użytkowników (0)