To tylko jedna z 20 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Elektrolity, kwasy i zasady
Elektrolit – substancja, która ulega dysocjacji.
Stopie dysocjacji, – liczba okre laj ca, jaka cz
ulega dysocjacji (mocne i słabe elektrolity).
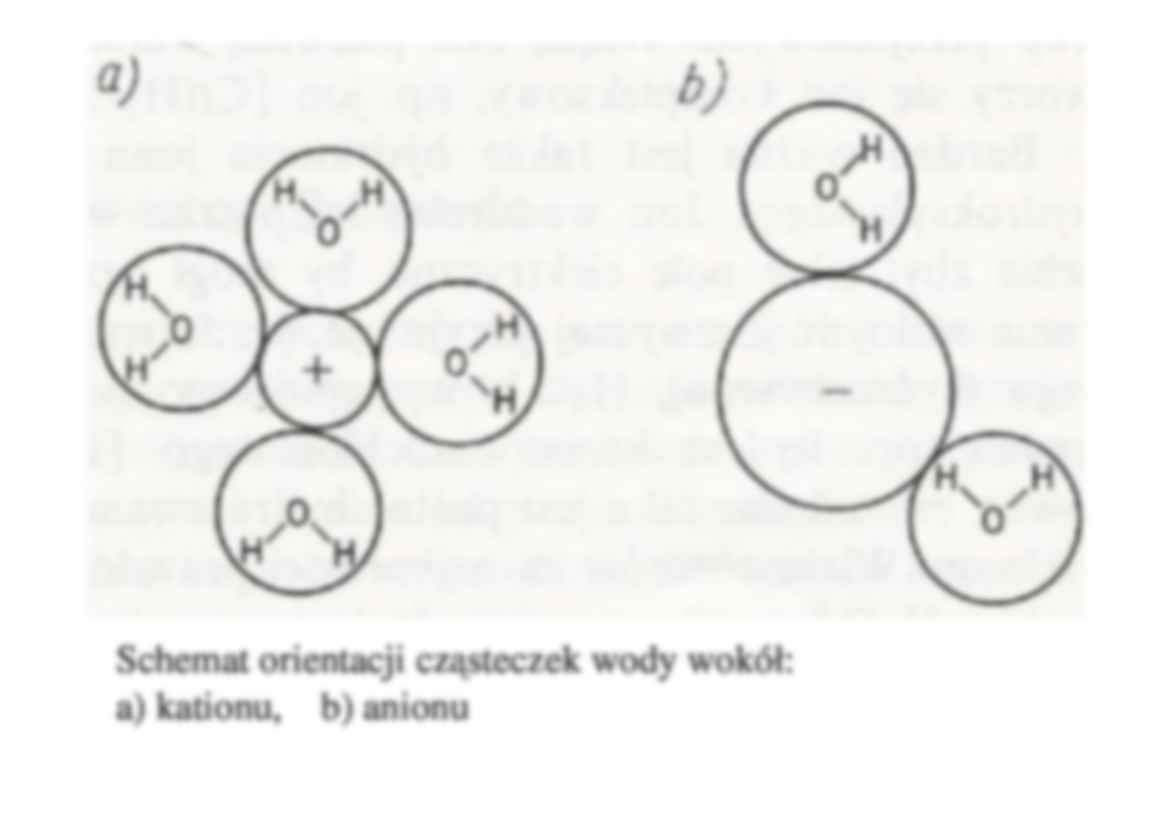
Zjawisko solwatacji, hydratacji.
elektrolitu
Schemat orientacji cz steczek wody wokół:
a) kationu, b) anionu
Hydratacja jonu wodorowego i wodorotlenowego
(hydroksylowego)
Jon wodorowy H+, wyst puje w postaci jonu
oksoniowego (hydroniowego), H3O+, wyst puj cego
w niektórych substancjach krystalicznych.
Ale do ko ca nie wiadomo czy taka wła nie forma
wyst puje w r-rze wodnym (mo e to by równie jon
czterowodny H9O4+)
Schemat hydratacji:
a) jonu wodorowego, b) jonu wodorotlenowego
Np. dysocjacja kwasu solnego i amoniaku:
HCl + 4H2O = H9O4+ + ClHCl + H2O = H3O+ + Cl-
NH3 + 4H2O = NH4+ + H7O4NH3 + H2O = NH4+ + OH-
W reakcji z kwasem cz steczka elektrolitu odszczepia
proton, a w reakcji z amoniakiem – proton
odszczepiany z wody jest pobierany.
W obydwu
przypadkach
nast piło
protonu – reakcja protolityczna.
przekazanie
Poj cie kwasu i zasady
Zgodnie z definicj Brönsteda kwas – substancja
zawieraj ca
cz steczki
zdolne
do
oddawania
protonów, a zasada – substancja zawieraj ca
cz steczki zdolne do pobierania protonów.
Kwas A oddaj c proton staje si
zasad
B (i
odwrotnie):
A ⇔ B + H+
Zasada B jest zasad sprz on z kwasem A.
A1 + B2 ⇔ B1 + A2
Rol zasady B2 mog
rozpuszczalnika (wody):
HCl + H2O ⇔ Cl- + H3O+
spełnia
tak e cz steczki
Zgodnie z def. Brönsteda rol kwasu mo e spełnia
nie tylko cz steczka oboj tna, ale równie jon ujemny
lub dodatni: (A1 + B2 ⇔ B1 + A2)
H2PO4- + H2O ⇔ HPO42- + H3O+
NH4+ + H2O ⇔ NH3 + H3O+
Ka da reakcja stanowi reakcj
pomi dzy dwiema
parami sprz onych z sob kwasów i zasad.
Proces dysocjacji zasady stanowi równie
protolityczn kwasowo-zasadow :
(B1 + A2 ⇔ A1 + B2)
NH3 + H2O ⇔ NH4+ + OH-
reakcj
Dysocjacja wody i pH
W czystej wodzie, nie zawieraj cej kwasów i zasad,
woda ulega w bardzo małym stopniu dysocjacji –
autodysocjacja:
H2O + H2O ⇔ H3O+ + OHZastosowa tutaj nale y prawo działania mas:
K =
'
w
cOH − ⋅ c H O +
3
c
2
H 2O
1
( 0)
c
ν
Kw = K c
'
w
2
H 2O
1 2
1 2
( 0 ) = cOH − ⋅ c H O + ( 0 )
3
c
c
K w = cOH − ⋅ c H O +
3
Stała równowagi Kw jest to iloczyn jonowy wody.
Dla czystej wody mo na zapisa :
1
1
−7
cOH − ( 0 ) = c H O + ( 0 ) = K w = 10
3
c
c
W r-rach oboj tnych pH = -log10-7 = 7
kwa nych: pH 7
Najprostszy sposób oznaczenia warto ci pH polega
na zastosowaniu wska ników.
Dysocjacja kwasów i zasad
Kwas jest mocnym kwasem, gdy w r-rze wodnym
ulega on bardzo daleko posuni tej dysocjacji, a słabym
– dysocjuje tylko mała jego cz .
Stała dysocjacji – mo na wyprowadzi rozwa aj c
dysocjacj kwasu HX w r-rze wodnym:
HX + H2O ⇔ H3O+ + X-
K =
'
a
c X − ⋅ cH O+
3
c HX ⋅ c H 2O
1
( 0)
c
ν
St enie cH2O w r-rze wodnym mo na przyj , e jest
stałe:
K a = K ⋅ c H 2O
'
a
Stała Ka – stała dysocjacji kwasu.
α ⋅c
Ka =
1−α
2
Wzór okre la zale no stopnia dysocjacji elektrolitu
od jego st enia –
... zobacz całą notatkę






Komentarze użytkowników (0)