To tylko jedna z 13 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


HYDROLIZA SOLI
Sól słabego kwasu i mocnej zasady:
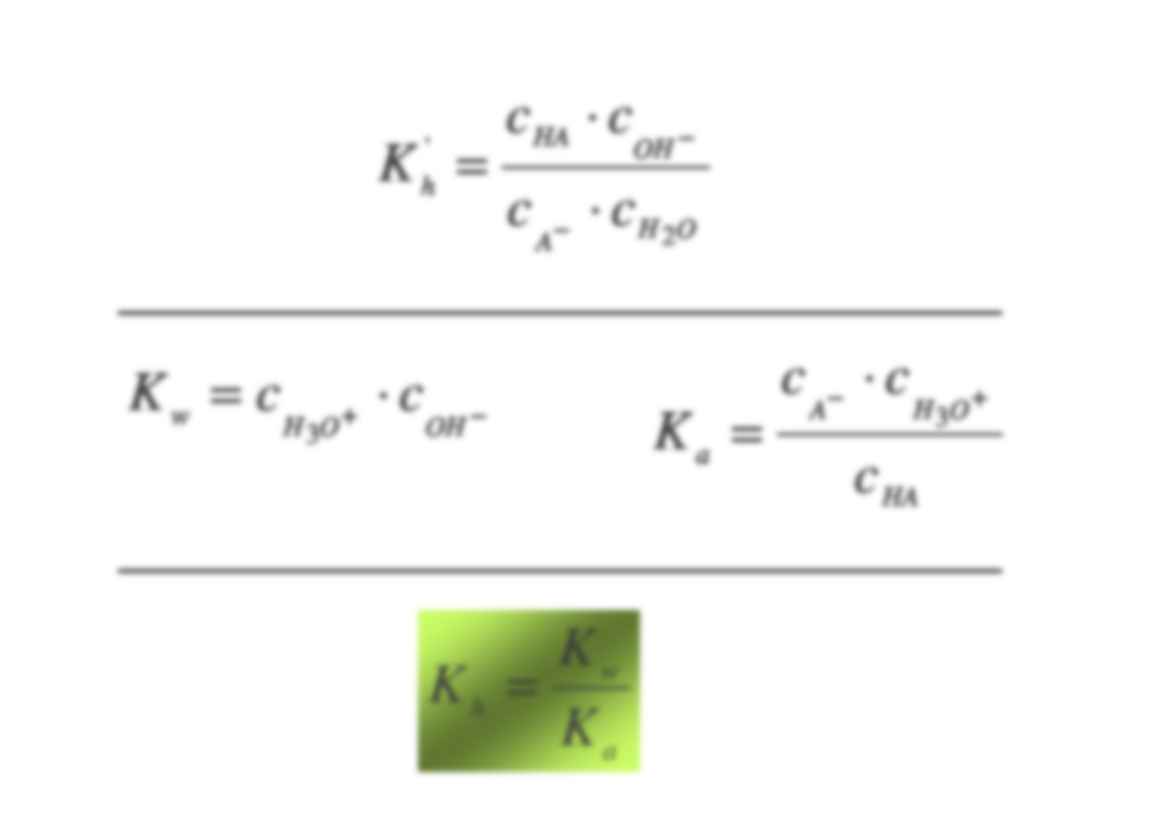
A- + H2O ⇔ HA + OHodczyn r-ru jest zasadowy wskutek obecno ci jonów
OH-.
K =
'
h
c HA ⋅ cOH −
c A − ⋅ c H 2O
K w = c H O + ⋅ cOH −
3
Kw
Kh =
Ka
Ka =
c A− ⋅ c H O +
3
c HA
Sól mocnego kwasu i słabej zasady:
M+ + H2O ⇔ MOH + H3O+
odczyn r-ru jest kwa ny wskutek obecno ci jonów
H3O+.
K =
'
h
c MOH ⋅ c H O +
3
c M + ⋅ c H 2O
K w = c H O + ⋅ cOH −
3
Kw
Kh =
Kb
Kb =
c M + ⋅ cOH −
c MOH
Sól słabego kwasu i słabej zasady:
A- + M+ + H2O ⇔ HA + MOH
c HA ⋅ c MOH
K =
c A − ⋅ c M + ⋅ c H 2O
'
h
K w = c H O + ⋅ cOH −
3
Ka =
c A− ⋅ c H O +
3
c HA
Kw
Kh =
Ka ⋅ Kb
Kb =
c M + ⋅ cOH −
c MOH
Roztwory buforowe
S to roztwory wykazuj ce odporno
na zmiany pH
podczas rozcie czania wod lub po dodaniu do nich
małych ilo ci kwasów (zasad).
Iloczyn rozpuszczalno ci
Proces
rozpuszczania
substancji jonowej:
AB(s) ⇔ A+(r) + B-(r)
trudno
rozpuszczalnej
Kx =
x A+ ⋅ x B −
x AB
= x A+ ⋅ x B −
c A+ c B −
K c = 0 ⋅ 0 = c A+ ⋅ c B −
c
c
K S ( AB ) = c A+ ⋅ c B −
Aktywno
elektrolitów
Dla elektrolitów mocnych oraz
redniej mocy
obserwuje si odst pstwa od prawa działania mas. W
tym celu zostało wprowadzone skorygowane st enie
w postaci, tzw. aktywno ci.
ci
ai = 0 ⋅ f i
c
Aby stosowa
prawo działania mas w szerokim
zakresie st e , nale y je przedstawi
w ogólnej
postaci wprowadzaj c zamiast st e aktywno ci:
Kc =
a A+ ⋅ a B −
a AB
aAB – aktywno
=
c A+ ⋅ c B −
c AB
1 f A+ ⋅ f B −
⋅ 0⋅
c
f AB
niezdysocjowanego elektrolitu,
f – odpowiednie współczynniki aktywno ci
W miar rozcie czania warto :
f A+ ⋅ f B −
f AB
Kc =
1
c A+ ⋅ c B −
c AB
K w = aOH − ⋅ a H O + = cOH − ⋅ c H O + ⋅ ( f OH − ⋅ f H O + )
3
3
3
Stałe dysocjacji kwasu i zasady:
Ka =
a X − ⋅ a H O+
3
a XH
Kb =
a BH + ⋅ aOH −
aB
... zobacz całą notatkę






Komentarze użytkowników (0)