To tylko jedna z 19 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

Charakterystyka stanów skupienia
W zale no ci od warunków, ci nienia i temperatury,
wszystkie substancje (przynajmniej teoretycznie) mog
wyst powa w trzech stanach skupienia (stany skupienia
materii):
• gazowym,
• stałym,
• ciekłym.
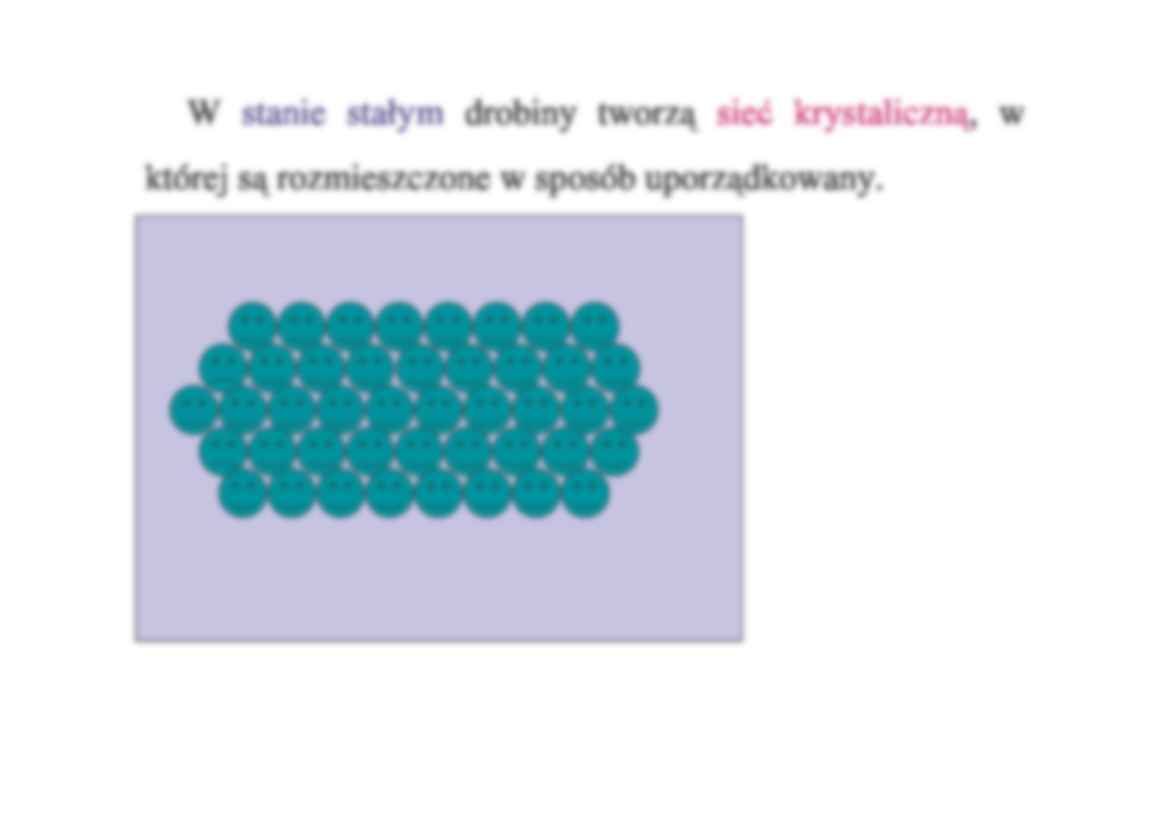
W stanie stałym drobiny tworz
sie
krystaliczn , w
której s rozmieszczone w sposób uporz dkowany.
Stan ciekły
Stan gazowy
Relacje
mi dzy
stanami
skupienia
Sublimacja
Parowanie
Kondensacja
CIECZ
Topnienie
Krzepni cie
CIAŁO STAŁE
Resublimacja
GAZ
Temperatury topnienia i wrzenia wi kszo ci czystych
substancji s dla nich stałymi charakterystycznymi.
Gaz doskonały i jego prawa
Aby opisywa gaz w sensie ilo ciowym, wprowadzono
poj cie gazu doskonałego.
Gazy rzeczywiste nie spełniaj wymienionych
warunków, gdy ich cz steczki maj okre lone wymiary
i istniej mi dzy nimi siły wzajemnego oddziaływania.
Prawo Boyle’a i Mariotte’a
Ci nienie gazu doskonałego w stałej temperaturze jest
odwrotnie proporcjonalne do obj to ci.
p1 V2
=
p 2 V1
lub
pV = const, T = const
Przemian zachodz c w stałej temperaturze naz. przemian
izotermiczn .
Prawo Gay-Lussaca
Je eli gaz b dziemy ogrzewa pod stałym ci nieniem, to
nast pi zwi kszenie jego obj to ci.
V1 T1
=
V2 T2
Przemian
lub
zachodz c
pod
przemian izobaryczn .
V
= const
T
stałym
p = const
ci nieniem
naz.
p = const
obj to , V
p p’ p’’
p’’
p’
p
temperatura, T
Prawo Charlesa
Je eli okre lon mas gazu znajduj cego si w naczyniu
zamkni tym o stałej obj to ci b dziemy ogrzewa , wówczas
zaobserwujemy zwi kszenie si ci nienia gazu.
p1 T1
p
= const
lub
=
T
p2
Przemian
T2
zachodz c
izochoryczn .
V = const
w stałej obj to ci naz. przemian
V = const
ci nienie, p
V V’ V’’
V’’
V’
V
temperatura, T
Równanie stanu gazu doskonałego.
Prawo Daltona.
Równanie Clapeyrona:
pV = nRT
R – uniwersalna stała gazowa,
n – liczba moli danego gazu,
T – temperatura bezwzgl dna.
C
B
V’
V1
p2
T=const
V2
A
T1
nst
o
=c
p
T2
p1
W przypadku etapu I, spełniona jest zale no :
T2
V
=
V1 T1
'
dla etapu II:
p1V1 p 2V2
=
T1
T2
(p=const)
p1V = p 2V2
'
lub
pV
= const = R
T
Gdy gaz zawiera n moli:
Stała R nie zale y od
uniwersalna stała gazowa.
pV
= nR
T
adnych parametrów stanu gazu,
Prawo Daltona
Gazy mieszaj
si
wzajemnie ze sob
w dowolnych
stosunkach, tworz c jednolite mieszaniny.
• pAV =nART
• pBV =nBRT
• pCV =nCRT
nA, nB, nC – liczby moli poszczególnych gazów
pA, pB, pC – ci nienia cz stkowe gazów
Sumarycznie ci nienie mieszaniny tych gazów jest równe:
RT
p = p A + p B + pC =
( n A + n B + nC )
V
... zobacz całą notatkę






Komentarze użytkowników (0)