To tylko jedna z 4 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
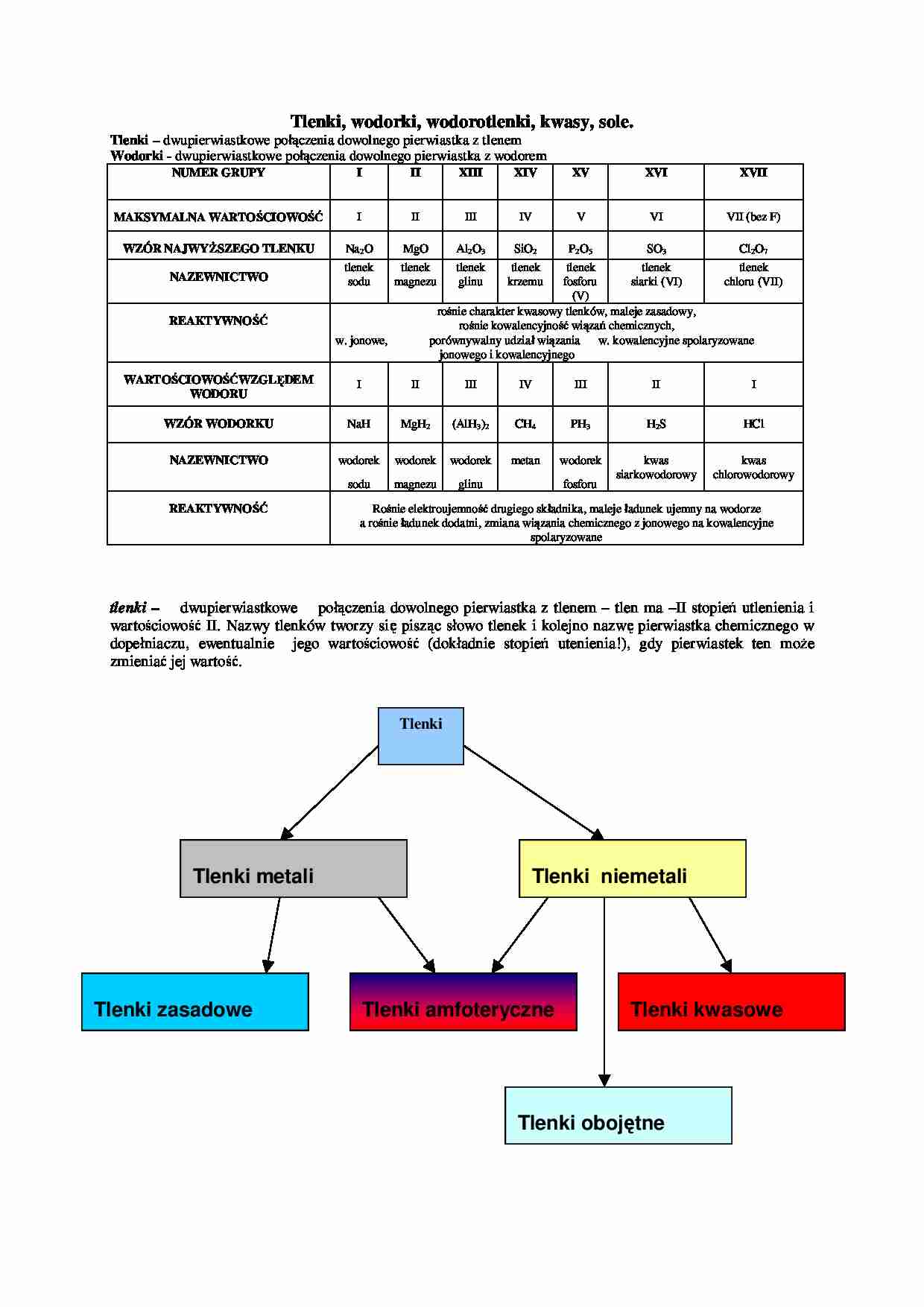


Tlenki, wodorki, wodorotlenki, kwasy, sole. Tlenki – dwupierwiastkowe połączenia dowolnego pierwiastka z tlenem Wodorki - dwupierwiastkowe połączenia dowolnego pierwiastka z wodorem NUMER GRUPY I II XIII XIV XV XVI XVII MAKSYMALNA WARTOŚCIOWOŚĆ I II III IV V VI VII (bez F) WZÓR NAJWYŻSZEGO TLENKU Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 NAZEWNICTWO tlenek sodu tlenek magnezu tlenek glinu tlenek krzemu tlenek fosforu (V) tlenek siarki (VI) tlenek chloru (VII) REAKTYWNOŚĆ rośnie charakter kwasowy tlenków, maleje zasadowy, rośnie kowalencyjność wiązań chemicznych, w. jonowe, porównywalny udział wiązania w. kowalencyjne spolaryzowane jonowego i kowalencyjnego WARTOŚCIOWOŚĆWZGLĘDEM WODORU I II III IV III II I WZÓR WODORKU NaH MgH2 (AlH3)2 CH4 PH3 H2S HCl NAZEWNICTWO wodorek sodu wodorek magnezu wodorek glinu metan wodorek fosforu kwas siarkowodorowy kwas chlorowodorowy REAKTYWNOŚĆ Rośnie elektroujemność drugiego składnika, maleje ładunek ujemny na wodorze a rośnie ładunek dodatni, zmiana wiązania chemicznego z jonowego na kowalencyjne spolaryzowane tlenki – dwupierwiastkowe połączenia dowolnego pierwiastka z tlenem – tlen ma –II stopień utlenienia i wartościowość II. Nazwy tlenków tworzy się pisząc słowo tlenek i kolejno nazwę pierwiastka chemicznego w dopełniaczu, ewentualnie jego wartościowość (dokładnie stopień utenienia!), gdy pierwiastek ten może zmieniać jej wartość. Tlenki Tlenki metali Tlenki niemetali Tlenki zasadowe Tlenki amfoteryczne Tlenki kwasowe Tlenki oboj ętne Podział tlenków: Zasadowe ( metali): reagują z substancjami kwasowymi: MnO + 2HCl = MnCl2 + H2O MgO + 2HCl = MgCl2 + H2O czasami reagują z wodą dając wodorotlenki – tylko 1 i 2 grupy układu okresowego za wyjątkiem berylu: K2O + H2O = 2KOH CaO + H2O = Ca(OH)2 bezwodnik zasadowy – to taki tlenek metalu w którym wartościowość jest taka sama jak w pewnym wodorotlenku tego metalu. Czasami ten tlenek w reakcji z wodą daje zasadę (tylko 1 i 2 gr. u.o.za wyjątkiem berylu). Kwasowe (metali i niemetali): reagują z substancjami zasadowymi: Mn2O7 + 4KOH = 2K2MnO4 + 2H2O
(…)
…)
Podział kwasów:
a) organiczne - zawierają grupę karboksylową -COOH
b) nieorganiczne.
• tlenowe,
• beztlenowe.
Kwasy nieorganiczne beztlenowe to roztwory wodne odpowiednich wodorków niemetali.
słabe
Nazewnictwo:
wzór
kwasu
H2S
HF
HCl
HBr
HI
nazwa kwasu
siarkowodorowy
fluorowodorowy
chlorowodorowy
bromowodorowy
jodowodorowy
nazwa
anionu
siarczkowy
fluorkowy
chlorkowy
bromki
jodki
H2S
HF
HCl
mocne
HBr
HI…
….
H2SO4 + K2SO3 = K2SO4 + H2SO3
3. Reakcja mniej lotnego kwasu z solą kwasu bardziej lotnego.
H2SO4 +2NaCl = Na2SO4 + 2HCl
H2SiO3 , H4SiO4 są w wodzie nierozpuszczalne (xSiO2. yH2O)
Podział kwasów:
a) organiczne - zawierają grupę karboksylową -COOH
b) nieorganiczne.
• tlenowe,
• beztlenowe.
Kwasy nieorganiczne beztlenowe to roztwory wodne odpowiednich wodorków niemetali.
HF
słabe
Nazewnictwo: H2S HCl…
... zobacz całą notatkę






Komentarze użytkowników (0)