To tylko jedna z 20 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

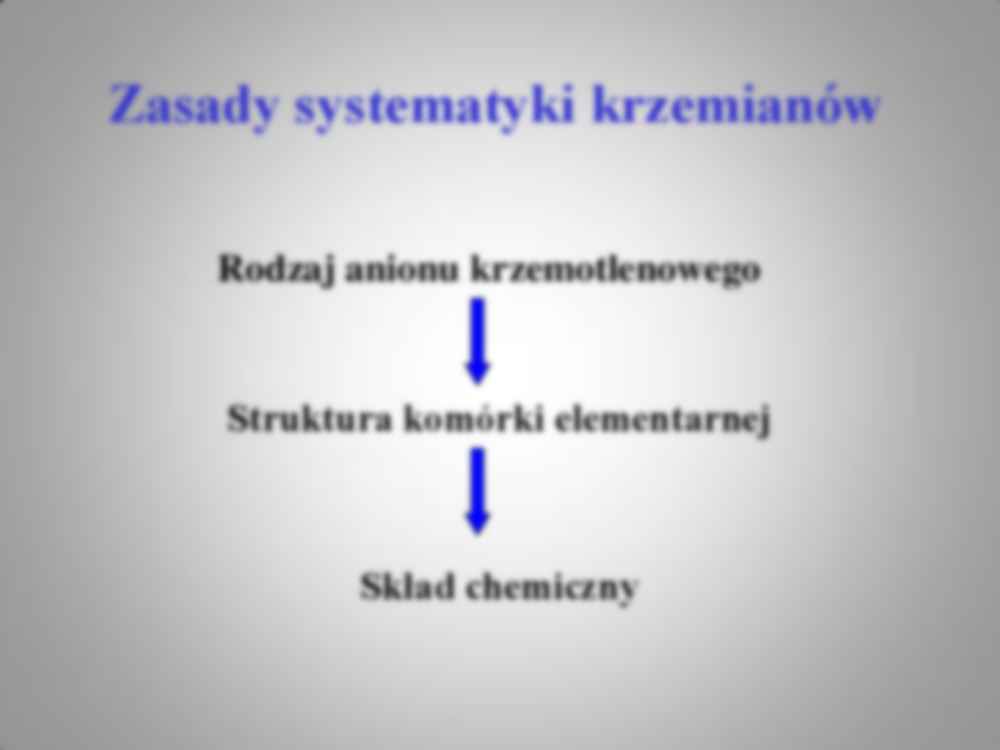
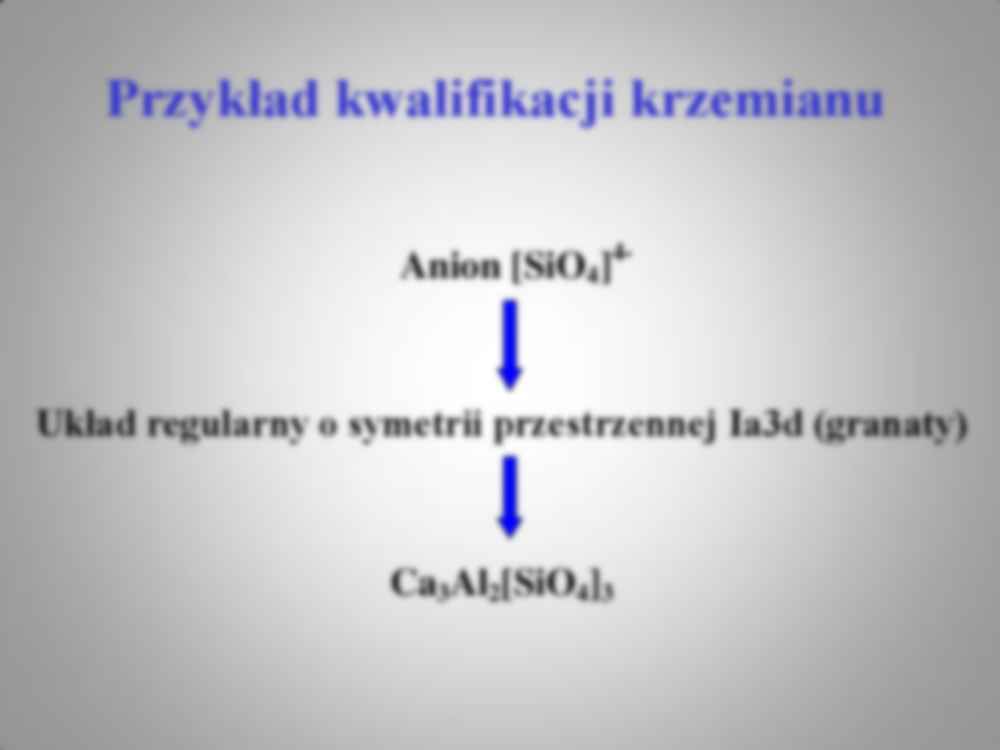
Wykład 2 Zasady systematyki krzemianów 1. Systematyka anionów krzemotlenowych. 2. Główne grupy krzemianów 3. Wzory koordynacyjne anionów krzemotlenowych 4. Charakter wiązania krzem tlen 5. Wiązanie Si–O w krzemianach 6. Krzemiany jako struktury jonowe Rodzaj anionu krzemotlenowego Struktura komórki elementarnej Skład chemiczny Zasady systematyki krzemianów Anion [SiO4] 4- Układ regularny o symetrii przestrzennej Ia3d (granaty) Ca3Al2[SiO4]3 Przykład kwalifikacji krzemianu Rodzaj anionu Przykłady anionu Stosunek (T : O) Ortokrzemiany Grupowe Łańcuchowe Warstwowe Szkieletowe [SiO4] 4- [Si2O7] 6-, [Si 3O10] 8- itd. [TO3] 2- [T4O10] 4- [TO2] 1 : 4 od 1 : 3.5 do 1 : 3 od 1 : 3 do 1 : 2.5 1 : 2.5 1 : 2 Klasyfikacja anionów wg.Bragga Grupa główna Podgrupy fsh T:O 1. Izolowane tetraedry lub grupy tetraedrów - pojedyncze - podwójne - potrójne - duże grupy - mieszane 1.00 1.25 1.33 1.33 -1.50 1.00 -1.50 1 : 4 1:3.5 1:3.33 1:3.33 - 1:3 1:3.67 - 1:3 2. Aniony liniowe – polimery 1-wymiarowe - łańcuchy pojedyncze - pierścienie pojedyncze - łańcuchy podwójne - pierścienie podwójne - łańcuchy wielokrotne - pierścienie wielokrotne - mieszane 1.50 1.50 1.50 -1.75 1.50 -1.75 1.50 – 2.00 1.50 – 2.00 1.50 – 2.00 1 : 3 1 : 3 1:3 - 1: 2.5 1:3 - 1: 2.5 1:3 – 1:2 1:3 – 1:2 1:3 – 1:2 3. Aniony warstwowe – polimery 2-wymiarowe - pojedyncze warstwy - podwójne warstwy - warstwy wielokrotne - warstwy mieszane 1.50 – 2.00 1.50 – 2.00 1.50 – 2.00 1.50 – 2.00 1:3 – 1:2 1:3 – 1:2 1:3 – 1:2 1:3 – 1:2 4. Struktury szkieletowe – polimery 3-wymiarowe Sieć przestrzenna tetraedrów 1.50 – 2.00 1:3 – 1:2 5. Aniony mieszane Klasyfikacja anionów wg.Zoltay’a 1. liczba koordynacyjna krzemu (CN – coordination number), która może przyjmować wartości 4, 5 i 6 ale najczęściej 4, 2. liczba łączeń - wspólnych naroży (L – linkedness ), dwa poliedry mogą się w ogóle nie łączyć (wówczas L=0) lub łączyć jednym wspólnym narożem (L=1), wspólną krawędzią (L=2) lub wspólną ścianą (L≥3), 3. rzędowość tetraedru – liczba tlenów mostkowych (s –connectedness ),
(…)
… 2pz
↑↓
↑↓
↑↓
↑
↑
↑↓
↑
↑
Wiązanie Si - O
- Długość wiązania Si-O wynosi od 1.57 do 1.72Å (średnio 1.62Å),
- Kąt między wiązaniami O-Si-O od 98o do 122o (średnio 109,47o),
- Kąt między tetraedrami Si-O-Si od 120o do 180o (średnio 140o).
Suma i stosunek promieni jonów krzemu i tlenu
Shannon
-Prewitt
Promień
jonowy
Pauling
rO2- [Å]
1.40
1.40
1.32
1.35
rSi4+ [Å]
0.41
0.44
0.39
0.26
rSi4++rO2-
1.81
1.88
1.71
1.61
rSi4+/ rO2-
0.29
0.31
0.29
0.19
Zachariasen Goldschmidt
Długość wiązania Si – O a kąt Si-O-Si
Najważniejsze czynniki różnicujące wiązanie krzem - tlen to:
1. terminalna (końcowa) lub mostkowa pozycja wiązania Si-O,
2. elektroujemność sąsiadującego z Si-Oter kationu metalu,
3. kąt między tetraedrami w przypadku wiązania Si-Obr,
Kąt Si_O-Si 120 130 140 150 160 170 180
dSi-O w krzem. 1.690…
… powtarzalnego (motyw struktury anionu)
wyrażonego liczbą tetraedrów lub wynikająca z przemienności krotność
pierścieni dla polianionów o D = 2 i 3. Przemienność i krotność pierścieni mogą
być stosowane zamiennie i są równoważne.
Główne grupy anionów krzemotlenowych
1. Niepolimeryczne krzemiany (D-0):
mono-, oligo- i cyklokrzemiany,
2. Inokrzemiany (D = 1) – łańcuchowe,
3. Fyllokrzemiany (D = 2) – warstwowe,
4…
... zobacz całą notatkę






Komentarze użytkowników (0)