To tylko jedna z 7 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


WYKŁAD 2_1
1. Pojęcie fazy i składnika
Faza to taka część układu, która jest jednorodna pod względem fizycznym i chemicznym
oraz oddzielona jest od obszarów układu o innych właściwościach powierzchnią. Na powierzchni tej następuje
skokowa zmiana właściwości.
Przykład 1 - mieszanina ciekłej wody i kostek lodu.
Suma wszystkich kawałków lodu to jedna faza, woda ciekła to druga faza.
(DWIE FAZY – STAŁA I CIEKŁA, JEDEN SKŁADNIK – H2O)
Przykład 2 -.mieszanina benzenu i toluenu w temperaturze 50°C p=1atm.
Roztwór ciekły (benzen+toluen), a nad nim opary – teŜ dwuskładnikowe.
Jest to układ dwufazowy (ciecz-para) dwuskładnikowy (benzen+toluen).
Dla układu jednoskładnikowego (substancja czysta) jakie są moŜliwe fazy? - gazowa (tylko jedna), ciekła (teŜ
tylko jedna),
stałe ( niektóre substancje występują w róŜnych odmianach polimorficznych).
Definicja fazy odnosi się do skali makro. RóŜnice mikro (np. fluktuacje gęstości ) nie są uwzględniane.
2. Nazewnictwo w przemianach fazowych
Przemiana ciecz→gaz to parowanie (wrzenie); przemiana gaz→ciecz to skraplanie (kondensacja).
Przemiana ciecz→ciało stałe to krystalizacja (krzepnięcie); przemiana ciało stałe→ciecz to topnienie.
Przemiana ciało stałe→gaz to sublimacja; przemiana gaz→ciało stałe to resublimacja.
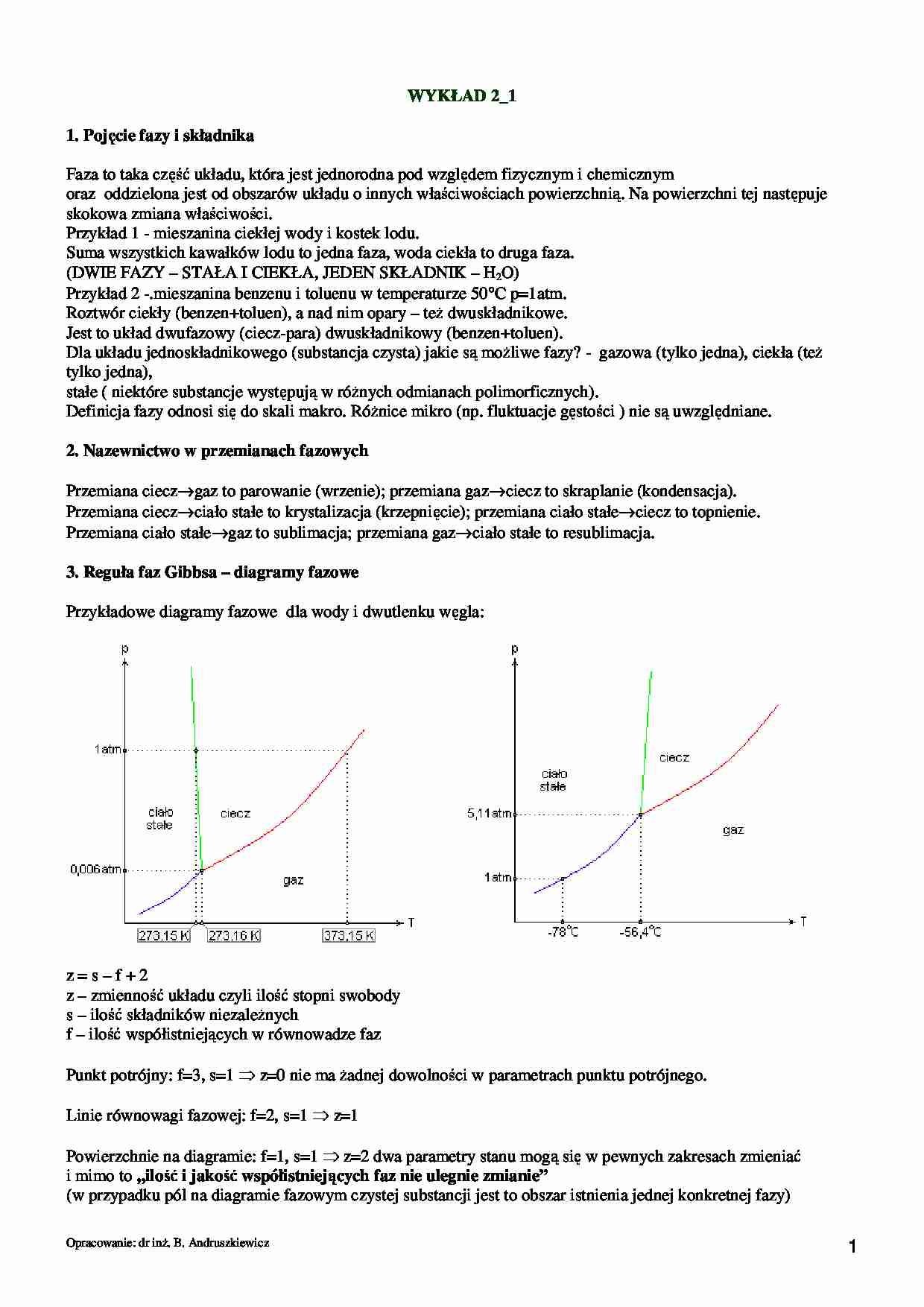
3. Reguła faz Gibbsa – diagramy fazowe
Przykładowe diagramy fazowe dla wody i dwutlenku węgla:
z=s–f+2
z – zmienność układu czyli ilość stopni swobody
s – ilość składników niezaleŜnych
f – ilość współistniejących w równowadze faz
Punkt potrójny: f=3, s=1 ⇒ z=0 nie ma Ŝadnej dowolności w parametrach punktu potrójnego.
Linie równowagi fazowej: f=2, s=1 ⇒ z=1
Powierzchnie na diagramie: f=1, s=1 ⇒ z=2 dwa parametry stanu mogą się w pewnych zakresach zmieniać
i mimo to „ilość i jakość współistniejących faz nie ulegnie zmianie”
(w przypadku pól na diagramie fazowym czystej substancji jest to obszar istnienia jednej konkretnej fazy)
Opracowanie: dr inŜ. B. Andruszkiewicz
1
4. Izotermiczno – izobaryczny charakter przemian fazowych
Przykład – 18g lodu (wody w stanie stałym ) o temperaturze -10°C ( p=1atm) ogrzewano doprowadzając ciepło w
tempie 100J na minutę. Narysować wykres zmian temperatury w funkcji czasu.
DANE
C P (st ) = 40
J
molK
∆H top = 6000
C P (c) = 75
J
mol
J
molK
∆H par = 40700
C P (g ) = 36
J
molK
J
mol
molowe pojemności cieplne wody w róŜnych stanach
skupienia
entalpia topnienia i entalpia parowania wody
Rysunek nosi nazwę krzywej ogrzewania lub - w przypadku odprowadzania ciepła - krzywej chłodzenia.
Odcinki poziome na krzywej ogrzewania to przemiany fazowe.
Dopóki są obecne dwie fazy (np. po 139 minutach ogrzewania obecne są ciecz i para), dopóty przy p=1atm
temperatura nie moŜe być inna niŜ 100°C. Dostarczane ciepło całe idzie na przemianę cieczy w parę.
18g H2O(para)
373K ,1atm
→
18g H2O(ciecz)
Vp =
m3
mol
= 40,73kJ / mol
VC = 0,000018
∆H par
∆U par = ∆H par − (p ∗ Vp − p ∗ VC ) = 40,73kJ / mol − 101325
Opracowanie: dr inŜ. B. Andruszkiewicz
RT 8,314 ∗ 373 m 3
=
p
(…)
… / mol
prod
substr
Opracowanie: dr inŜ. B. Andruszkiewicz
3
Zadanie b). Obliczyć entalpię reakcji uwodornienia benzenu do cykloheksanu w temperaturze 350K.
W jakich stanach skupienia będą poszczególne reagenty? Dana temperatura wrzenia benzenu
Twrz1=353,3K,temperatura wrzenia cykloheksanu Twrz3=353,8K , molowe pojemności cieplne reagentów wynoszą:
C P1 = 136,1J / molK; C P 2 = 28,8J / molK; C P3…
... zobacz całą notatkę






Komentarze użytkowników (0)