OZNACZANIE JONÓW CHLORKOWYCH W WODZIE
Metoda merkurymetryczna
Zasada oznaczenia
Podczas miareczkowania roztworu zawierającego jony chlorkowe jonami rtęci (II) następuje stopniowe tworzenie się kompleksów: HgCl42-, HgCl3-, HgCl2, HgCl+. Ponieważ kompleks HgCl2 jest znacznie trwalszy od HgCl+, po utworzeniu się HgCl2 w roztworze wzrasta stężenia jonów rtęci (II), które reagują ze wskaźnikiem (difenylokarbazonem) tworząc kompleks o zabarwieniu niebiesko-fioletowym. Miareczkowanie chlorków roztworem rtęci (II) przeprowadza się w środowisku słabo kwaśnym (pH 1,5-2,0). Metodę tą stosuje się do oznaczania małych zawartości jonów chlorkowych, stąd użyteczna jest w analizie wody. W oznaczeniu tym przeszkadzają następujące jony: chromianowe, metali alkalicznych, żelaza (III) (powyżej 10 mg/dm3), fosforanowe. Oznaczaniu chlorków nie przeszkadzają fluorki, siarczany, azotany i octany oraz jony wapnia, magnezu, glinu, manganu i cynku. Za pomocą tej metody można oznaczać także jony bromkowe, cyjankowe i rodankowe.
Przygotowanie roztworów
- roztwór podstawowy chlorku sodu o stężeniu 10-2 [mol/dm3]
odważyć w naczynku wagowym 0,0584 g NaCl cz.d.a. i przenieść (używając lejka) do kolbki miarowej o pojemności 100 cm3, następnie uzupełnić wodą destylowaną do kreski i dokładnie wymieszać ( 30 razy)
- roztwory wzorcowe chlorków o stężeniach [mol/dm3]: 10-3, 10-4, 10-5 metodą kolejnych rozcieńczeń ( 10 cm3 r-ru o stęż. 10-2 rozcieńczamy w kolbce na 100 cm3) i podobnie postępujemy z dalszymi roztworami
Wykonanie oznaczenia
Do kolby stożkowej o pojemności 300 cm3 odmierzamy 50,00 cm3 (pipetą jednomiarową) badanego roztworu i dodajemy 5-8 kropli wskaźnika. Jeśli barwa roztworu (po dodaniu wskaźnika) przybierze barwę niebiesko-fioletową, należy dodawać kroplami, stale mieszając, 0,2 M kwas azotowy (V) do uzyskania żółtego zabarwienia i ponadto 1 cm3 w nadmiarze. Jeśli natomiast po dodaniu wskaźnika próbka zabarwi się na żółto, należy ją zobojętnić za pomocą 2 M wodorotlenku sodu do zmiany barwy roztworu na różową. Następnie zmiareczkować roztwór mianowanym roztworem azotanu rtęci (II) (0,0125 M) do zmiany zabarwienia na fioletowe.
UWAGA: miareczkujemy kolejno roztwory: wodę (ślepa próba), roztwory wzorcowe chlorków o stężeniach: 10-3, 10-4, 10-5 [mol/dm3] i analizę wydaną przez prowadzącego (w trzech powtórzeniach).
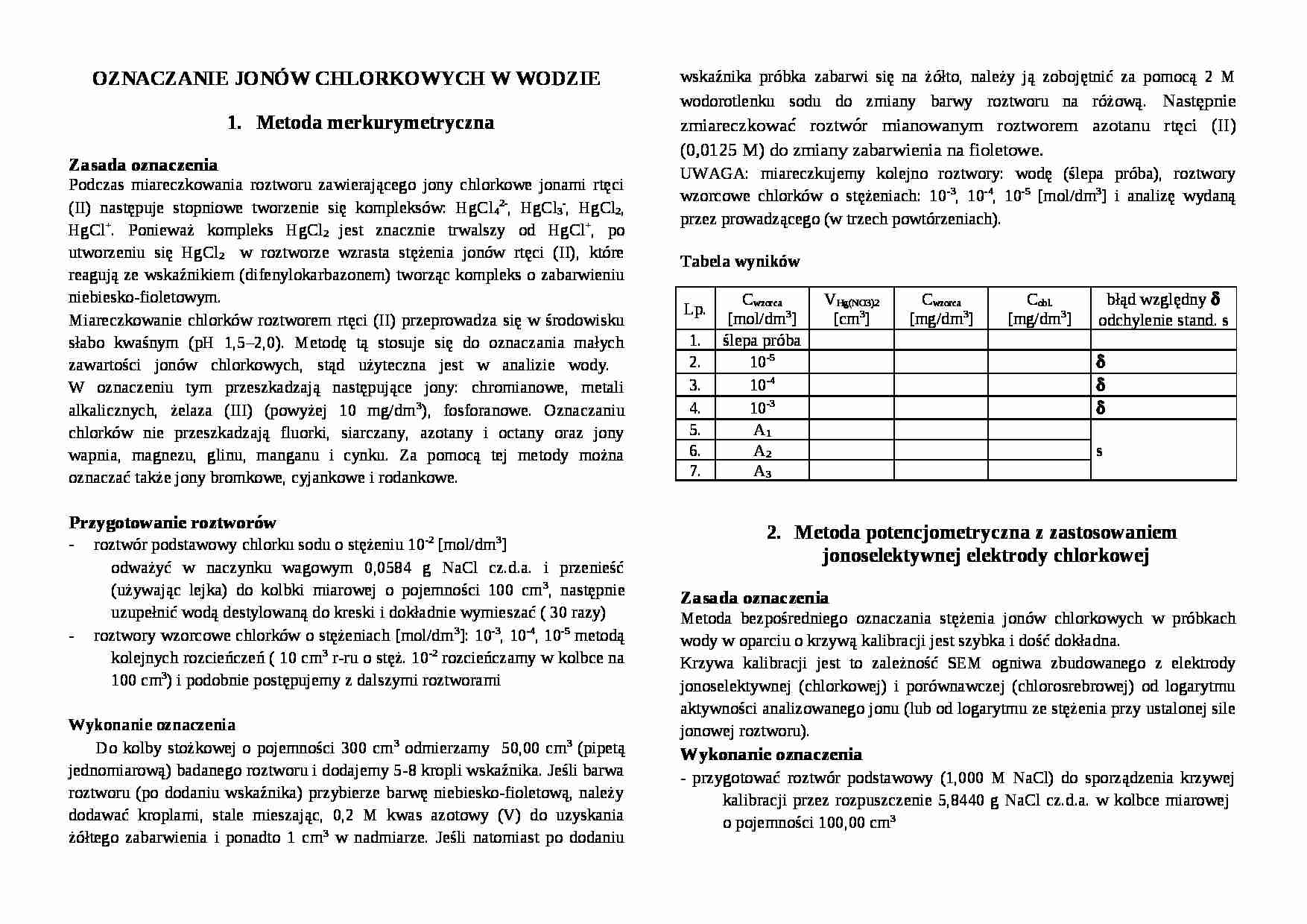
Tabela wyników
Lp.
Cwzorca
[mol/dm3]
VHg(NO3)2
[cm3]
Cwzorca
[mg/dm3]
Cobl.
[mg/dm3]
błąd względny δ odchylenie stand. s
1.
ślepa próba
(…)
…) i porównawczej (chlorosrebrowej) od logarytmu aktywności analizowanego jonu (lub od logarytmu ze stężenia przy ustalonej sile jonowej roztworu).
Wykonanie oznaczenia
- przygotować roztwór podstawowy (1,000 M NaCl) do sporządzenia krzywej kalibracji przez rozpuszczenie 5,8440 g NaCl cz.d.a. w kolbce miarowej o pojemności 100,00 cm3 - zbudować układ pomiarowy składający się z jonoselektywnej elektrody chlorkowej…
… próbek.
Tabela wyników
Lp.
Cwzorca
[mol/dm3]
SEM
[mV]
C z wykresu
[mol/dm3]
Cobl.
[mg/dm3]
odchylenie standardowe s
1.
10-5
---
2.
10-4
---
3.
10-3
---
4.
10-2
---
5.
10-1
---
6.
100
---
7.
A1
s
8.
A2
9.
A3
Literatura
Monika Zabłocka, Praca dyplomowa, Instytut Chemii i Metalurgii Pierwiastków, Politechniki Wrocławskiej 1995.
Walenty Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, 1996…
... zobacz całą notatkę



Komentarze użytkowników (0)