To tylko jedna z 40 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Wstęp do elektrochemii
Wykład 2, cz. 1
Elektroda - półogniwo
• Jest to układ złożony z dwóch faz
przewodzących:
• 1. Stały przewodnik
• 2. Elektrolit
• Na granicy faz tworzy się potencjał
• Związany jest z powstawaniem podwójnej
warstwy elektrycznej
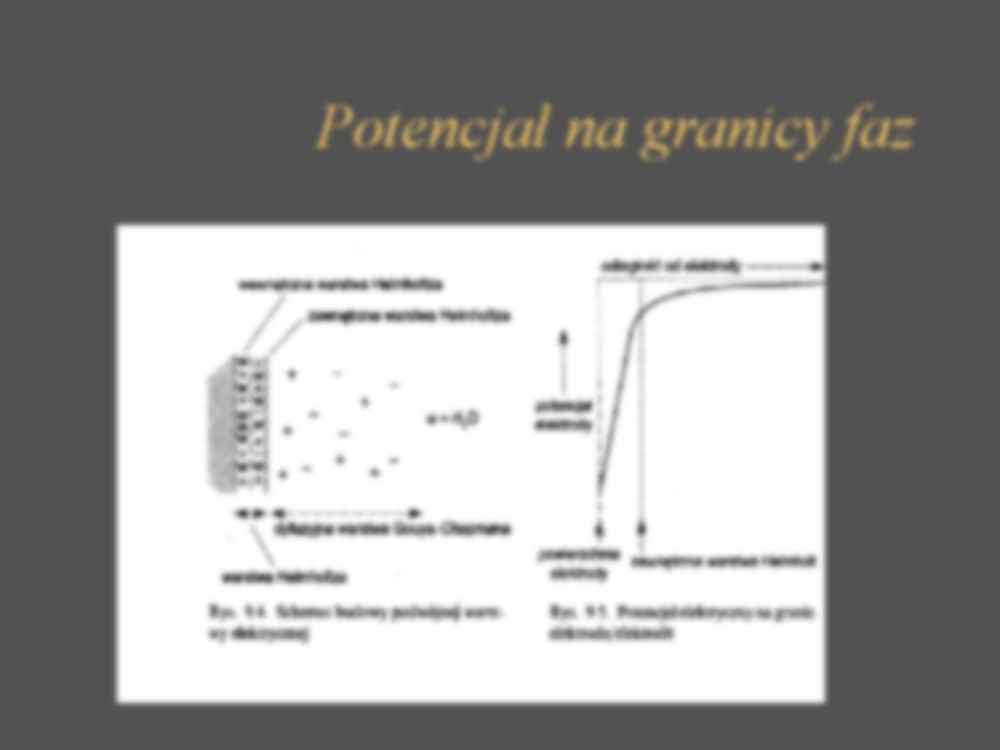
Potencjał na granicy faz
Warstwy Helmholtza
• Zorientowanie dipoli wody w pobliżu powierzchni
elektrody. Monomolekularna ukierunkowana
warstwa rozpuszczalnika – wewnętrzna warstwa
• Ukierunkowane dipole wody powodują wzrost
stężenia jonów jednego znaku w porównaniu z
roztworem daleko od elektrody. Nadmiar lub
niedomiar ładunków indukuje równy co do
wartości ale o znaku przeciwnym ładunek
elektrody
Warstwa Gouya - Chapmana
• Tam gdzie ładunek nadmiarowy powoli
zanika tworzy się nadmiarowa warstwa
dyfuzyjna.
Potencjał elektrody
Ogniwo galwaniczne
Reakcje elektrodowe
• Reakcje elektrodowe dotyczą przepływu ładunku
z elektrody do roztworu i odwrotnie od roztworu
do elektrody. Przepływ elektronu towarzyszy
reakcjom zdefiniowanym jako redukcyjno –
oksydacyjne: redox
utlenianie
• Cu (0) Cu (2+ aq) + 2e
Redukcja
• Cu (2+ aq) + 2e Cu (0)
Ogólna formuła
Postać utleniona + ne
postać zredukowana
Potencjał elektrod, reakcje zachodzące na
elektrodach (redoks)
Elektroda
Cu/CuSO4
Elektroda
Ag/AgCl
Cu2+ + 2e- Cu
AgCl + e- Ag + Cl
Klucz elektrolityczny
• Rurka wypełniona
roztworem KCl
SEM ogniwa
Ogniwo Daniella
• Ogniwo zbudowane jest z dwóch półogniw
z których każde zanurzone jest w roztworze
swojej soli.
• Cu(s) / Cu2+ (aq) (redukcja)
Reakcja elektrodowa: Cu2+ (aq) + 2e Cu(s)
• Zn(s) / Zn2+ (aq) (utlenianie)
Reakcja elektrodowa: Zn(s) Zn2+ (aq) + 2e
Ogniwo Daniella
• Reakcje półogniw można zapisać w postaci
jednego równania
• Zn(s) + Cu2+ (aq) + 2e
Zn2+ (aq) + 2e +Cu(s)
• Jeżeli półogniwa połączymy kluczem
elektrolitycznym i elektrody podłączymy do
woltomierza to możemy zmierzyć różnicę
potencjałów ( SEM) powstałego ogniwa
Konwencja IUPAC
• Schematyczny zapis ogniwa Daniella
(-)Zn/Zn2+ Cu2+/Cu(+)
E ogniwa = E katody (prawa) – E anody (lewa)
Pojedyncze linie oznaczają granice faz elektroda
roztwór , podwójne klucz elektrolityczny.
Potencjał na granicy faz jest wynikiem reakcji
redoks. Elektroda na której zachodzi utlenianie
jest anodą, na katodzie zachodzi redukcja
Aparatura potencjometryczna
• Potencjometr,
(woltomierz) ale prąd
przepływający przez
to urządzenie jest
mniejszy niż 10-11 A
• Pary elektrod
zanurzonych w
roztworze
Równanie Nernsta
E
E0
RT ared
ln
zF aoks
Równanie Nernsta
•
•
•
•
•
•
•
•
E, potencjał elektrody
E0, standardowy potencjał elektrody
R, stała gazowa 8,314JK-1mol-1
T, temperatura w K
Z, wartościowość jonu
F, stała Faradaya 9,64846x104 C mol-1
ln a = 2,303 log a
Aktywności: a = 1 dla fazy stałej (metal)
Zastosowanie równania Nernsta
Standardowe potencjały
• Pomiar przeprowadza się w 298 K
• Aktywność jonów czynnych 1 mol dm-3
• Potencjały elektrod wyznaczane są
względem standardowej elektrody
wodorowej, który wynosi 0,0000 V
Elektroda
... zobacz całą notatkę






Komentarze użytkowników (0)