To tylko jedna z 11 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
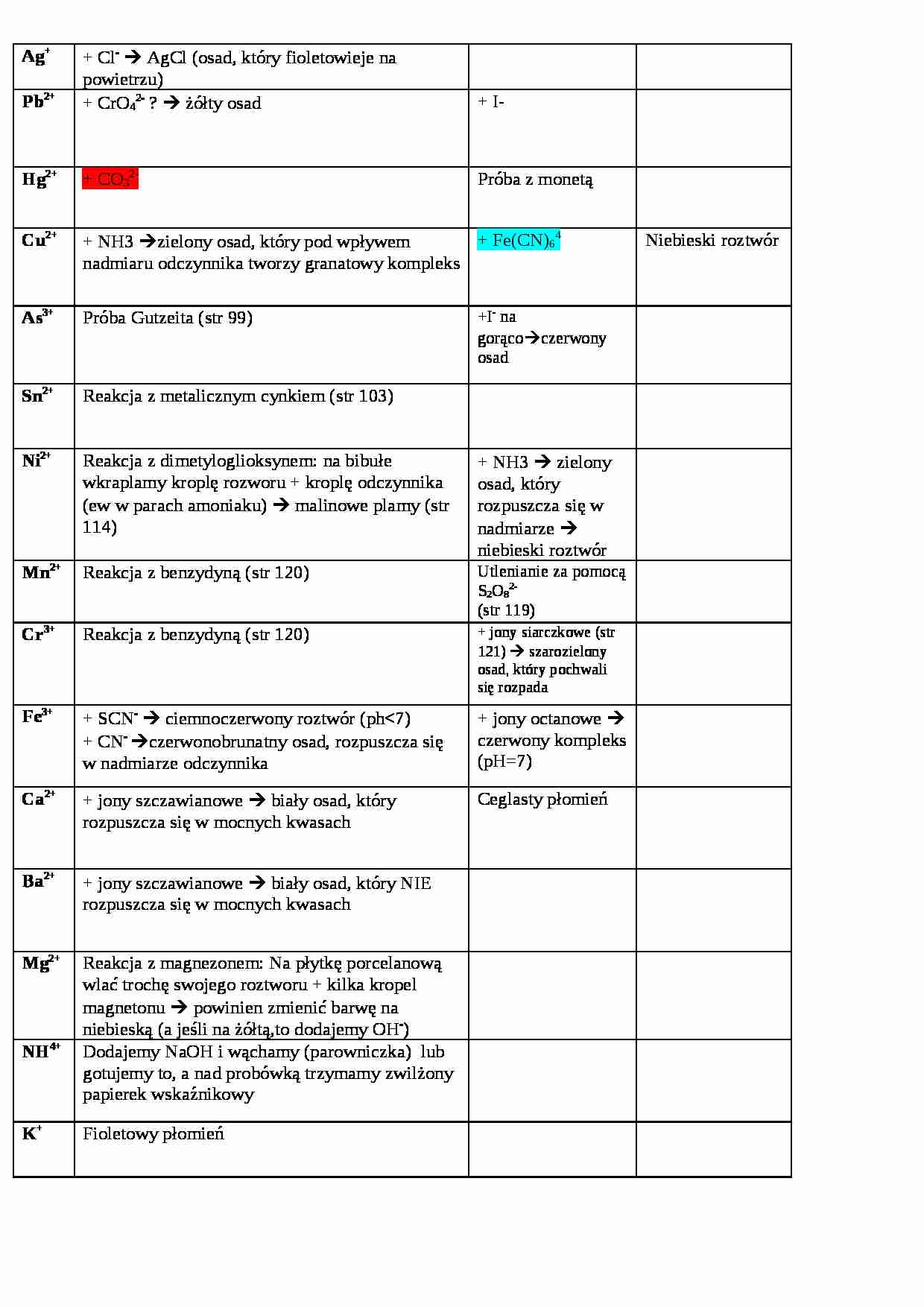


1 strona w formacie doc w formie tabeli z podziałem na poszczególne kationy. W notatce sposoby wykrywania kationów grup 1-5 umieszczonych w 1 probówce. W treści notatki pojawiają między innymi takie pojęcia jak: Próba Gutzeita, zielony osad, który pod wpływem nadmiaru odczynnika tworzy granatowy kompleks, reakcja z metalicznym cynkiem, reakcja z dimetyloglioksynem, reakcja z benzydyną, ciemnoczerwony roztwór, jony szczawianowe, biały osad, który nie rozpuszcza się w mocnych kwasach, reakcja z magnezonem, NaOH.
Ag+
+ Cl- AgCl (osad, który fioletowieje na powietrzu)
Pb2+
+ CrO42- ? żółty osad
+ I-
Hg2+
+ CO32-
Próba z monetą
Cu2+
+ NH3 zielony osad, który pod wpływem nadmiaru odczynnika tworzy granatowy kompleks
+ Fe(CN)64
Niebieski roztwór
As3+
Próba Gutzeita (str 99)
+I- na gorącoczerwony osad
Sn2+
Reakcja z metalicznym cynkiem (str 103)
Ni2+
Reakcja z dimetyloglioksynem: na bibułe wkraplamy kroplę rozworu + kroplę odczynnika (ew w parach amoniaku) malinowe plamy (str 114)
+ NH3 zielony osad, który rozpuszcza się w nadmiarze niebieski roztwór
Mn2+
Reakcja z benzydyną (str 120)
Utlenianie za pomocą S2O82-
(str 119)
Cr3+
Reakcja z benzydyną (str 120)
+ jony siarczkowe (str 121) szarozielony osad, który pochwali się rozpada
Fe3+
+ SCN- ciemnoczerwony roztwór (ph<7) + CN- czerwonobrunatny osad, rozpuszcza się w nadmiarze odczynnika
+ jony octanowe czerwony kompleks (pH=7)
Ca2+
+ jony szczawianowe biały osad, który rozpuszcza się w mocnych kwasach
Ceglasty płomień
Ba2+
+ jony szczawianowe biały osad, który NIE rozpuszcza się w mocnych kwasach
Mg2+
Reakcja z magnezonem: Na płytkę porcelanową wlać trochę swojego roztworu + kilka kropel magnetonu powinien zmienić barwę na niebieską (a jeśli na żółtą,to dodajemy OH-)
NH4+
Dodajemy NaOH i wąchamy (parowniczka) lub gotujemy to, a nad probówką trzymamy zwilżony papierek wskaźnikowy
K+
Fioletowy płomień
... zobacz całą notatkę






Komentarze użytkowników (0)