To tylko jedna z 41 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


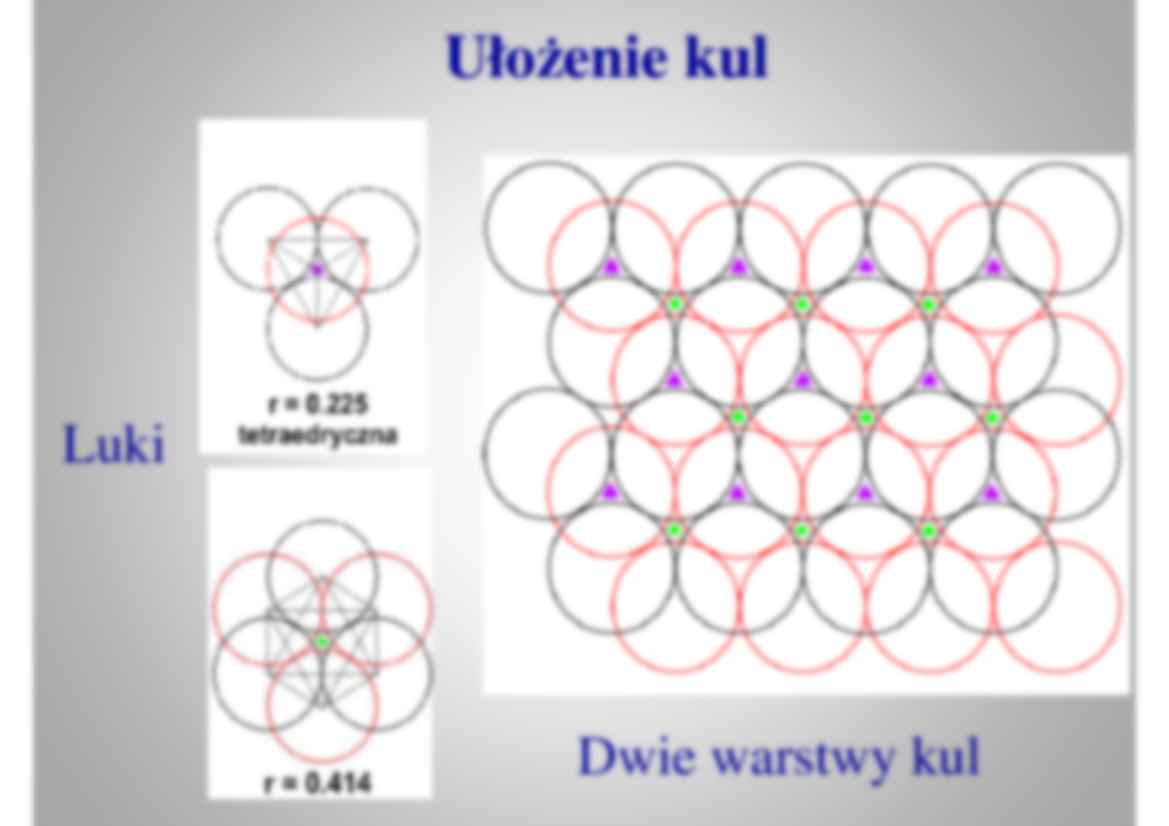
Wykład 11 Kryształy jonowe 1. Model kryształów jonowych. 2. Wielko ś ci charakteryzuj ą ce jony w krysztale. 3. Reguły Paulinga. 4. Podział struktur jonowych. 5. Przykłady struktur jonowych • izodesmiczne kryształy jonowe typu: AB, A B , AB oraz tlenki • izodesmiczne kryształy jonowe typu: AB, A 2B3, AB2 oraz tlenk zło Ŝ one • anizodesmiczne kryształy jonowe z kompleksami typu:[AX]n-, [AX 2] n-, [AX 3] n-, [AX 4] n-, [AX 6] n- • Mezodesmiczne struktury krzemianów. Model kryształów jonowych 1. Jony w strukturach kryształu s ą naładowanymi, sztywnymi nie polaryzowalnymi sferami, których promie ń sztywnymi nie polaryzowalnymi sferami, których promie ń nie przenikalno ś ci okre ś lamy jako promie ń jonowy. 2. Jony jednego znaku s ą otoczone jonami przeciwnego znaku (ligandami) tak aby ich liczba (liczba koordynacyjna) była mo Ŝ liwie najwi ę ksza. 3. Jony tego samego znaku układaj ą si ę tak aby energia ich odpychania elektrostatycznego była mo Ŝ liwie ich odpychania elektrostatycznego była mo Ŝ liwi najmniejsza. 4. Układ jonów jednego znaku wokół jonów znaku przeciwnego jest trwały wówczas gdy jon centralny styka si ę z jonami otaczaj ą cymi (g ę ste upakowanie). Uło Ŝ enie kul Uło Ŝ enie ku Luki Dwie warstwy kul Parametry okre ś laj ą ce jony w Parametry okre ś laj ą ce jony w strukturach kryształów jonowych strukturach kryształów jonowyc 1. Promie ń jonowy r K i rA 2. Liczba koordynacyjna 3. Ładunek jonu 4. Warto ś ciowo ść (wytrzymało ść ) wi ą zania. 4. Warto ś ciowo ść (wytrzymało ść ) wi ą zani G ę sto ść elektronowa G ę sto ść elektronowa G ę sto ść elektronow G ę sto ść elektrono a promie ń jonowy a promie ń jonow Odległo ść mi ę dzyjonowa d Odległo ść mi ę dzyjonowa K-A= d = (hkl) (hkl d LiF = 2.01Å d LiCl = 2.57Å d LiBr = 2.75Å d LiF = 2.01Å d NaF = 2.31Å d KF = 2.66Å d RbF = 2.82Å d LiCl = 2.57Å d NaCl = 2.81Å d KCl = 3.14Å d RbCl = 3.27Å d LiBr = 2.75 d NaBr = 2.98Å d KBr = 3.29Å d RbBr = 3.43Å r K + rA = dK-A = d(hkl) r K + rA = ? Metody wyznaczania promieni jonowych 1. Metoda Goldschmidta (1926) polegaj ą ca na zale Ŝ no ś ci promienia od refrakcji jonowej (R ~ r4 j), 2. Metoda Landego (1920), który zało Ŝ ył, Ŝ e w miar ę wzrostu liczby 2. Metoda Landego (1920), który zało Ŝ ył, Ŝ e w miar ę wzrostu liczb porz ą dkowej anionu w szeregu np. MgO. MgS, MgSe jego promie
(…)
….
Czynniki wpływające na wielkość
promieni jonowych.
1. Ładunek jonu (stopień utlenienia), kationy są tym mniejsze im
większy ładunek kationu zaś aniony są znacznie większe od
kationów o tej samej konfiguracji elektronowej.
np. S2- - 1.85Å, S0 - 1.04Å, S6+ - 0.34Å.
2. Liczba atomowa pierwiastka, im większa tym większy promień
np. 3Li+ – 0.74Å, 11Na+ – 1.02Å, 19K+ – 1.38Å
3. Polaryzowalność jonu.
4. Liczba…
… koordynacyjnego
2
3
4
4
6
8
8
12
12
Liniowa lub angularna
Trójkatna płaska lub piramidalna
Tetraedryczna (czworościenna)
Kwadratowa płaska
O ktaedryczna (ośmiościenna)
A ntypryzmatyczna
Sześcienna
Ikosaedryczna (dwudziestościenna)
K ubooktaedryczna
r K /r A
< 0.155
0.155 – 0.225
0.225 – 0.414
0.414 – 0.645
0.645 – 0.732
0.732 – 0.905
0.905 – 1.000
> 1.000
Ładunek jonu
1. Ładunek formalny (Z) – stopień utlenienia…
…
Struktury anizodesmiczne
Zawierają w sieci obok kationów kompleksy typu:
[AX]n-, [AX2]n-, [AX3]n-, [AX4]n-, [AX6]n-,
Są to na przykład:
- wodorotlenki, nadtlenki, cyjanki itp.
- sole kwasów tlenowych np. azotyny, azotany, siarczany, itp.
Wodorotlenki
Mg(OH)2 – brucyt
Al(OH)3 - gibsyt
Ca(OH)2
[AX3
Kalcyt CaCO3
Dolomit (Mg,Ca)CO3
n]
Aragonit CaCO3
Magnezyt MgCO3
[AX4]nCaSO4·2H2O gips
CaSO4anhydryt
Ca3(PO4)2…
... zobacz całą notatkę






Komentarze użytkowników (0)