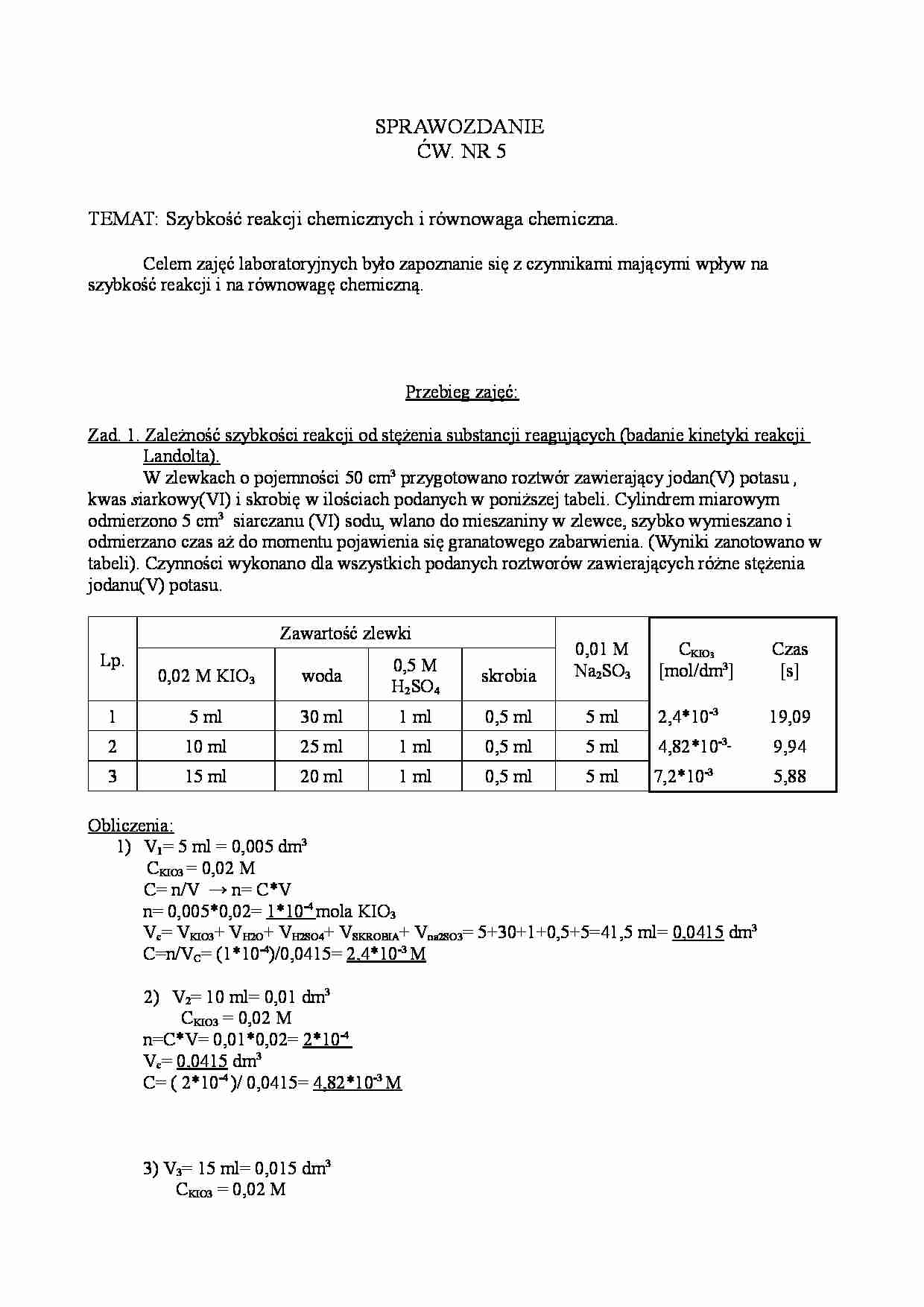
SPRAWOZDANIE ĆW. NR 5 TEMAT: Szybkość reakcji chemicznych i równowaga chemiczna. Celem zajęć laboratoryjnych było zapoznanie się z czynnikami mającymi wpływ na szybkość reakcji i na równowagę chemiczną. Przebieg zajęć: Zad. 1. Zależność szybkości reakcji od stężenia substancji reagujących (badanie kinetyki reakcji Landolta). W zlewkach o pojemności 50 cm3 przygotowano roztwór zawierający jodan(V) potasu , kwas s iarkowy(VI) i skrobię w ilościach podanych w poniższej tabeli. Cylindrem miarowym odmierzono 5 cm3 siarczanu (VI) sodu, wlano do mieszaniny w zlewce, szybko wymieszano i odmierzano czas aż do momentu pojawienia się granatowego zabarwienia. (Wyniki zanotowano w tabeli). Czynności wykonano dla wszystkich podanych roztworów zawierających różne stężenia jodanu(V) potasu. Lp. Zawartość zlewki 0,01 M Na2SO3 CKIO 3 [mol/dm3] Czas [s] 0,02 M KIO3 woda 0,5 M H2SO4 skrobia 1 5 ml 30 ml 1 ml 0,5 ml 5 ml 2,4*10-3 19,09 2 10 ml 25 ml 1 ml 0,5 ml 5 ml 4,82*10-3 9,94 3 15 ml 20 ml 1 ml 0,5 ml 5 ml 7,2*10-3 5,88 Obliczenia: 1) V1= 5 ml = 0,005 dm3 CKIO3 = 0,02 M C= n/V → n= C*V n= 0,005*0,02= 1*10 -4 mola KIO3 Vc= VKIO3+ VH2O+ VH2SO4+ VSKROBIA+ Vna2SO3= 5+30+1+0,5+5=41,5 ml= 0,0415 dm3 C=n/VC= (1*10-4)/0,0415= 2,4*10 -3 M 2) V2= 10 ml= 0,01 dm3 CKIO3 = 0,02 M n=C*V= 0,01*0,02= 2*10 -4 Vc= 0,0415 dm3 C= ( 2*10-4 )/ 0,0415= 4,82*10 -3 M 3) V3= 15 ml= 0,015 dm3 CKIO3 = 0,02 M n=C*V= 0,015* 0,02=3*10 -4 mola KIO3 Vc= 0,0415 dm3 C=n/V= (3*10-4)/ 0,0415= 7,2*10 -3 M Zaobserwowano: Po połączeniu jodu ze skrobią otrzymujemy granatowe zabarwienie. Ze wzrostem stężenia jodu szybkość reakcji wzrasta. Im większe stężenie jodu tym szybciej otrzymujemy granatowe zabarwienie roztworu. 2JO3- + 5SO32- + 2H+ = J2 + 5SO42- + H2O Zad.2. Wpływ temperatury na szybkość reakcji chemicznych. a) 3 g NH4Cl rozpuszczono w ciepłej wodzie, w małej zlewce, używając do tego celu 10 cm3 wody. Analogicznie przygotowano roztwór zawierający 4 g NaNO2, rozpuszczając go w 10 cm3 wody. Następnie odmierzono po 3 cm3 każdego z roztworów i wlano je do probówki z korkiem, lekko wstrząsano jego zawartość i pozostawiono otwierając korek. Zaobserwowano: Oba roztwory były klarowne. Po zmieszaniu wydzieliły się pęcherzyki gazu. b) Powtórzono doświadczenie zlewając takie same objętości substratów, które zostały uprzednio ogrzane do temperatury 70ºC. Obserwowano zmiany w intensywności wydzielania
(…)
… perhydol (30% H2O2) do 1/3 objętości. Do pierwszej z
probówek wrzucono grudkę braunsztynu, do drugiej nieco węgla aktywnego. Trzecią pozostawiono
do porównania z samym perhydrolem. Żarzącym się łuczywkiem sprawdzono intensywność
wydzielania się gazu.
Zaobserwowano:
Rozkład nadtlenku wodoru w obecności braunsztynu zachodzi bardzo gwałtownie. Łuczywko
zbliżone do wylotu probówki bardzo intensywnie się żarzy…
… NaCl otrzymujemy biały, mętny roztwór. Powstała substancja
trudno rozpuszczalna.
NaCl + AgNO3 → NaNO3 + ↓ AgCl
Na+ + Cl- + Ag++ NO3-→ Na+ + NO3- + AgCl↓
BIAŁY OSAD
+
-
Ag + Cl → ↓ AgCl
b) powstaje produkt łatwo lotny
Do około 5 cm3 1 M Na2CO3 dodano około 2 cm3 1 M Hcl.
c) powstaje produkt słabo zdysocjonowany
W probówce przygotowano roztwór octanu sodu. Następnie dodano do niego 2 M roztwór kwasu…
... zobacz całą notatkę





Komentarze użytkowników (0)