To tylko jedna z 83 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
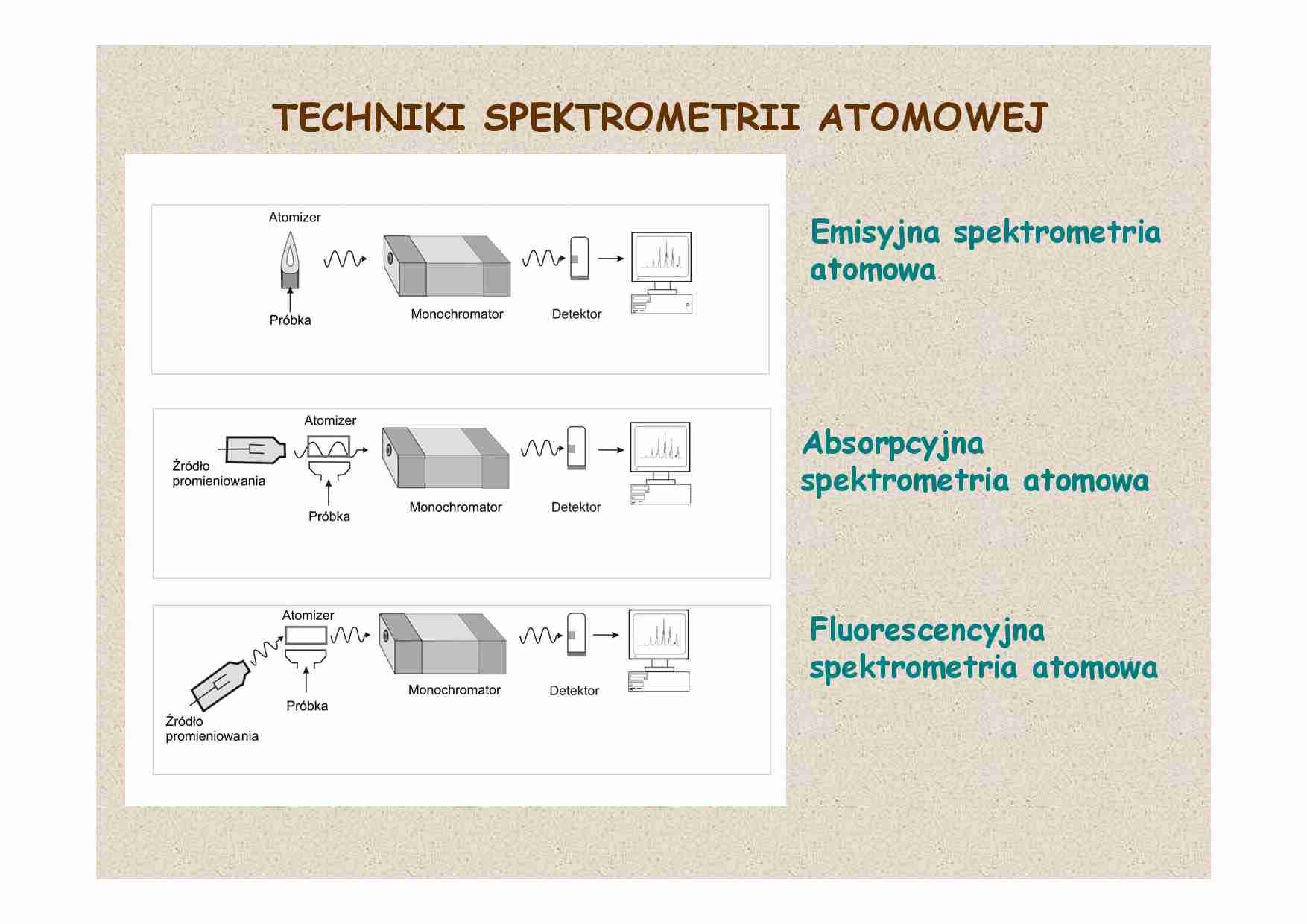


TECHNIKI SPEKTROMETRII ATOMOWEJ
Emisyjna spektrometria
atomowa
Absorpcyjna
spektrometria atomowa
Fluorescencyjna
spektrometria atomowa
Informacje uzyskiwane w oparciu o pomiary
spektroskopowe:
- skład chemiczny obiektu – identyfikacja sygnałów
spektroskopowych
- temperatura – identyfikacja stanów uczestniczących w
przejściu promienistym
- zawartość poszczególnych cząstek – porównanie
(analiza) intensywności (natężenia) sygnałów
- ruch cząstek, ciśnienie, natężenie pola magnetycznego –
analiza szerokości sygnałów (linii spektralnych)
ANALIZA ABSORPCYJNA
Stała, ciekła, gazowa
Próbka
Ogrzewanie (np. płomień)
Atomizacja
Przepuszczenie promieniowania
Absorpcja
Pryzmat, siatka
Rozszczepienie
promieniowania
po absorpcji
Fotopowielacz,
fotodioda, CCD
Detekcja
Ręczna, komputerowa
Obróbka danych
Jakościowe, ilościowe
Wyniki analityczne
ANALIZA EMISYJNA
Stała, ciekła, gazowa
Próbka
Bezposrednie, nebulizacja...
Wprowadzenie próbki
Płomień, łuk, iskra...
Atomizacja, wzbudzenie
Emisja promieniowania
Pryzmat, siatka
Rozszczepienie
promieniowania
Fotopowielacz,
fotodioda, CCD
Detekcja
Ręczna, komputerowa
Obróbka danych
Jakościowe, ilościowe
Wyniki analityczne
Analiza próbki
analiza związków
chemicznych
i grup aktywnych
analiza pierwiastków
analiza
koncentracji
całkowitych
analiza
specjacyjna
Pb2+, Pb(OH)2, Pb(OH)42-,
(CH3)4Pb, (CH3CH2)4Pb
ATOMIZACJA
ATOMIZERY
piec grafitowy
płomień
źródła plazmowe
źródła wzbudzenia
Atomowa spektrometria absorpcyjna ASA
Atomic absorption spectrometry AAS
Określenie ilości
światła:
transmitancja
% absorpcji
absorbancja
zaabsorbowanego
T = I/I0
(%T = I*100%/I0)
%A = 100% - %T
A = log (I0/I)
(A = const*c)
Stężenie charakterystyczne – stężenie pierwiastka (w
mg/dm3), dla którego absorbancja wynosi 0,0044 (99%T)
– pozwala na optymalizację parametrów, oszacowanie
wartości absorbancji i dopasowanie rozcieńczenia próbki
Praktyczny zakres absorbancji: 0 – 1,00
Najmniejszy błąd względny : 0,4 – 0,7
Wybór odpowiedniej długości fali
- oznaczanie Cu
długość fali
stężenie charakterystyczne
Budowa typowego spektrometru do
absorpcji atomowej
źródło
promieniowania
Atomizer
PRÓBKA
Źródła promieniowania:
- lampy z katodą wnękową (hollow cathode lamp - HCL)
- lampy bezelektrodowe (electrodeless discharge lamp
- EDL) – bardziej trwałe, mniej stabilne
lampy z katodą wnękową HCL:
gaz plazmotwórczy: Ne, Ar (2 –
6 Torr)
katoda: metal, półmetal, stal +
folia lub spieki, stopy metali
(lampy wielopierwiastkowe)
parametry prądowe: i = 5 – 30
mA, U = 600 V
Budowa HCL
a – katoda
b – anoda
c – izolacja
d – zasilanie
e – okienko kwarcowe
Mechanizm wzbudzenia (uproszczony) w katodzie wnękowej
lampy jednopierwiastkowe i wielopierwiastkowe
Atomizcja:
płomieniowa (flame atomic absorption
spectrometry FAAS) – ciecze i gazy
poprzez elektryczne ogrzewanie oporowe
(graphite furnance, electrothermal
vaporization GF-AAS, ET(V)-AAS) – ciecze,
zawiesiny i ciała stałe
odparowanie laserowe (laser ablation LA) –
... zobacz całą notatkę






Komentarze użytkowników (0)