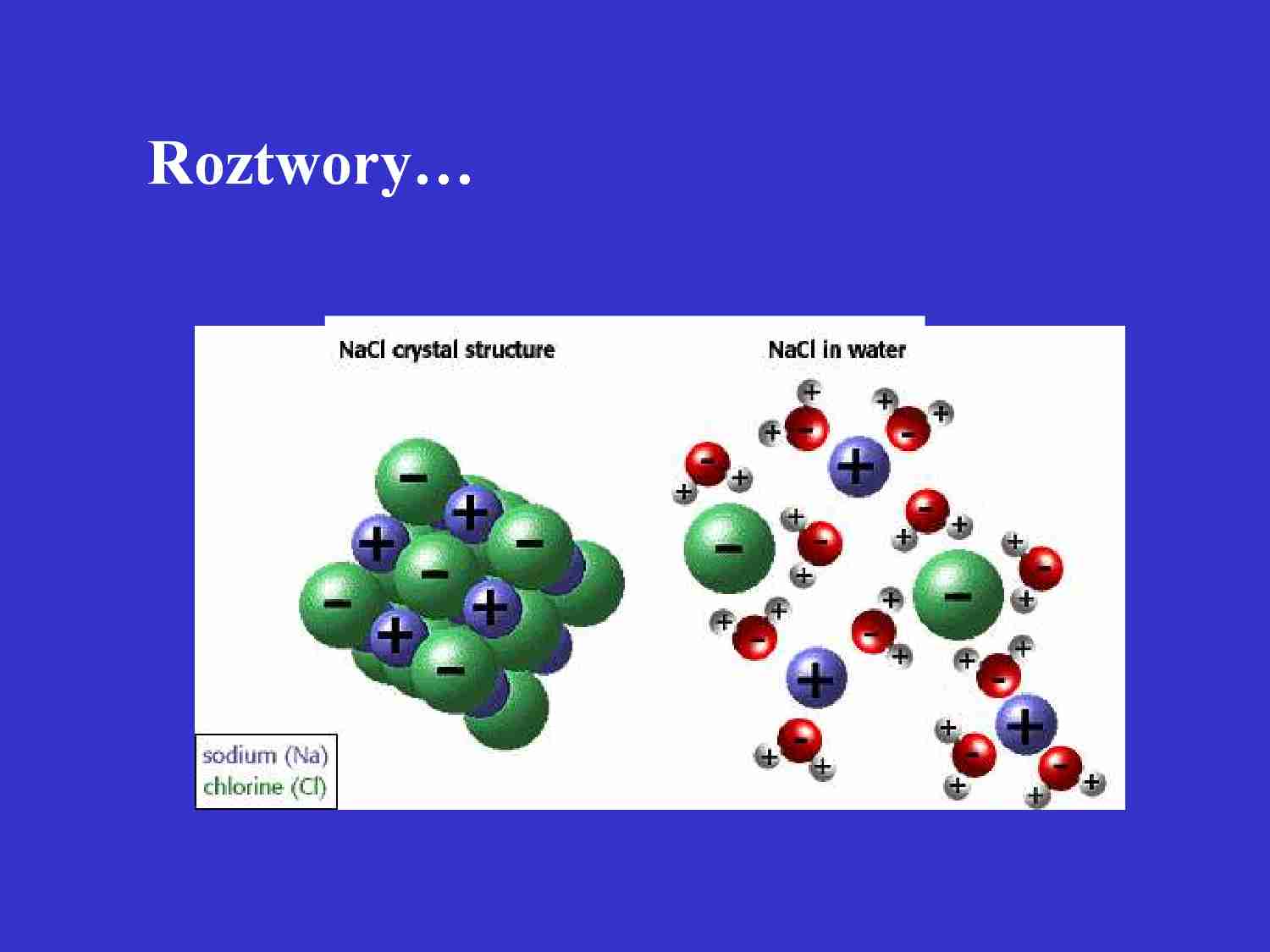
Roztwory…
Nie wszystkie substancje dysocjują w roztworach wodnych.
Warunkiem takiego zachowania się jest odpowiednia budowa i rodzaj
wiązania w cząsteczkach związku chemicznego.
Cząsteczki wody mają budowę polarną, są dipolami:
przykład;
(-)
O
H
H
(+)
W rezultacie dipole wody powodują osłabienie, a następnie rozerwanie
wiązania związku i uwolnienie jonów na : dodatni kation H+ i ujemny anion
B(przykład dysocjacja HCL)
H2O
HCL H+ + CL –
Jeżeli równowaga dysocjacji jest przesunięta w kierunku tworzenia jonów,
to w roztworze nie ma(jest bardzo mało) cząsteczek niezdysocjowanych.
Takie roztwory bardzo dobrze przewodzą prąd elektryczny.
Elektrolity i nieelektrolity
Elektrolity:
• kwasy, zasady i sole podczas
rozpuszczania w wodzie
rozpadają się na elementy
naładowane elektrycznie, czyli
ulegają tzw. dysocjacji
elektrolitycznej (jonowej).
(jonowej).
Elementy te nazwano jonami.
jonami.
Jony naładowane dodatnio
nazywa się kationami, a ujemne
kationami,
anionami.
anionami.
• suma ładunków elektrycznych
kationów i anionów,
powstających na skutek
dysocjacji elektrolitycznej
elektrolitów jest zawsze równa
zeru.
Nie elektrolity:
• substancje, które w
roztworach i w stanie
stopionym nie przewodzą
prądu elektrycznego, nie
ulegają dysocjacji
elektrolitycznej.
• właściwości chemiczne jonów
różnią się zupełnie od
własności obojętnych atomów
i cząsteczek
• Cząsteczki substancji rozpuszczonej
pod wpływem cząsteczek wody
ulegają w roztworze rozpadowi na
jony dodatnie (kationy) i jony ujemne
(aniony) jest to proces dysocjacji
elektrolitycznej.
Stężenie substancji w roztworze
Components of a solution
Solution concentration units
jeden mol – one mole
Liczba Avogadro – Avogadro’s Number = 6,022 1023/mol
molarność – molarity (M) – w litrze --- mg/l
molalność - molality (m) – w kilogramie --- ppm
moralność – morality (?) – w duszy ---
morderczość – mortality (...) – w piekle ---
Molarność - ilość moli substancji
rozpuszczonej w 1 dm3 roztworu
lub przez jego molalność tj. ilość moli
w 1000 g rozpuszczalnika
1 litrze wody deszczowej
0,00005 kg=0,05 g=50 mg
1 litrze wody z kranu
0,00015 kg=0,15 g=150 mg
Ilość rozpuszczonych soli (minerałów) w:
0,01 kg= 10 g= 10000 mg
1 litrze tzw. SOLANKI, wody
WYSOKOZMINERALIZOWANEJ
0,0005 kg=0,5 g=500 mg
1 litrze wody
ŚREDNIOZMINERALIZOWANEJ
0,001 kg= 1 g= 1000 mg
1 litrze WODY MINERALNEJ
Aktywność substancji w
roztworze, aktywność
jonowa
Obliczenia termodynamiczne dla różnego rodzaju reakcji, stanów,
nasyceń pomiędzy fazami wymagają uwzględnienia sił
elektrostatycznych związanych np. z otoczkami hydratacyjnymi wokół
jonów i obecności kompleksów wodnych; np. w czystej wodzie:
wodnych;
Tarcze
elektrostatyczne
Powoduje to obniżenie reaktywności jonów – czyli ich AKTYWNOŚCI
(stężenia efektywnego).
Aktywność jonu osiąga wartość stężenia molowego, gdy stężenie
molowego,
molowe jonu zbliża się do 0!!!
W bardziej stężonych roztworach należy
uwzględnić pewien współczynnik aktywności ,
przez który trzeba
(…)
…+) i
żelaza (Fe3+->Fe2+), redukcja siarczanów (S6+ -> S2+) i azotu, fermentacja.
WYMIANA JONOWA
wg „Hydrogeochemia”, Macioszczyk, 1987 oraz „Hydrogeochemia strefy aktywnej wymiany wód podziemnych”, Macioszczyk, Dobrzyński , 2002
Dobrzyński, 2002
Zdolność wymiany jonowej wybranych minerałów w mval/100 g minerału
wg „Hydrogeochemia”, Macioszczyk, 1987 oraz „Hydrogeochemia strefy aktywnej wymiany wód podziemnych”, Macioszczyk, Dobrzyński , 2002
Dobrzyński, 2002
Wykres zależności pojemności wymiany kationowej (CEC) od procentowego
udziału kaolinitu i montmorillonitu
wg „Hydrogeochemia”, Macioszczyk, 1987 oraz „Hydrogeochemia strefy aktywnej wymiany wód podziemnych”, Macioszczyk, Dobrzyński , 2002
Dobrzyński, 2002
Następujące czynniki warunkują przebieg i intensywność procesów wymiany jonowej zachodzących…
… liczba jonów mogących brać udział w procesach wymiany jonowej w danych warunkach
zwana jest pojemnością wymiany jonowe BEC. Wyraża się ją w milivalach na 100 g suchego
BEC.
adsorbenta
wg „Hydrogeochemia”, Macioszczyk, 1987 oraz „Hydrogeochemia strefy aktywnej wymiany wód podziemnych”, Macioszczyk, Dobrzyński , 2002
Dobrzyński, 2002
Zdolność wymiany jonowej wybranych minerałów w mval/100 g minerału
wg…
… MINERAŁÓW C.D.
wg „Hydrogeochemia”, Macioszczyk, 1987 oraz „Hydrogeochemia strefy aktywnej wymiany wód podziemnych”, Macioszczyk, Dobrzyński , 2002
Dobrzyński, 2002
Podczas typowego rozpuszczania minerałów skałotwórczych do roztworu dostają się:
•metale alkaliczne (Na, K, Li),
•metale ziem alkalicznych (Ca, Mg, Sr, Ba) oraz
•Fe i Mn, głównie w formie wodorowęglanów.
•część krzemionki w postaci kwasów…
… pierwiastków). Tworzy ponad 200 minerałów, z których
najbardziej rozpowszechnione są: arsenopiryt, lelingit, orpiment, realgar.
Często towarzyszący także złożom siarczkowym innych metali, np.: pirytom,
chalkopirytom, galenie, blendzie cynkowej. W naturze arsen występuje również w
niektórych związkach organicznych, tj. kwas metyloarsenowy(V), kwas
metyloarsenowy(III), kwas dimetyloarsenowy(V) (kwas kakodylowy…
... zobacz całą notatkę




Komentarze użytkowników (0)