1. Prawo Kirchhoffa wyraża równanie:
ΔrH'(T2)= ΔrH'(T1)+ ΔrC'p dT (1)
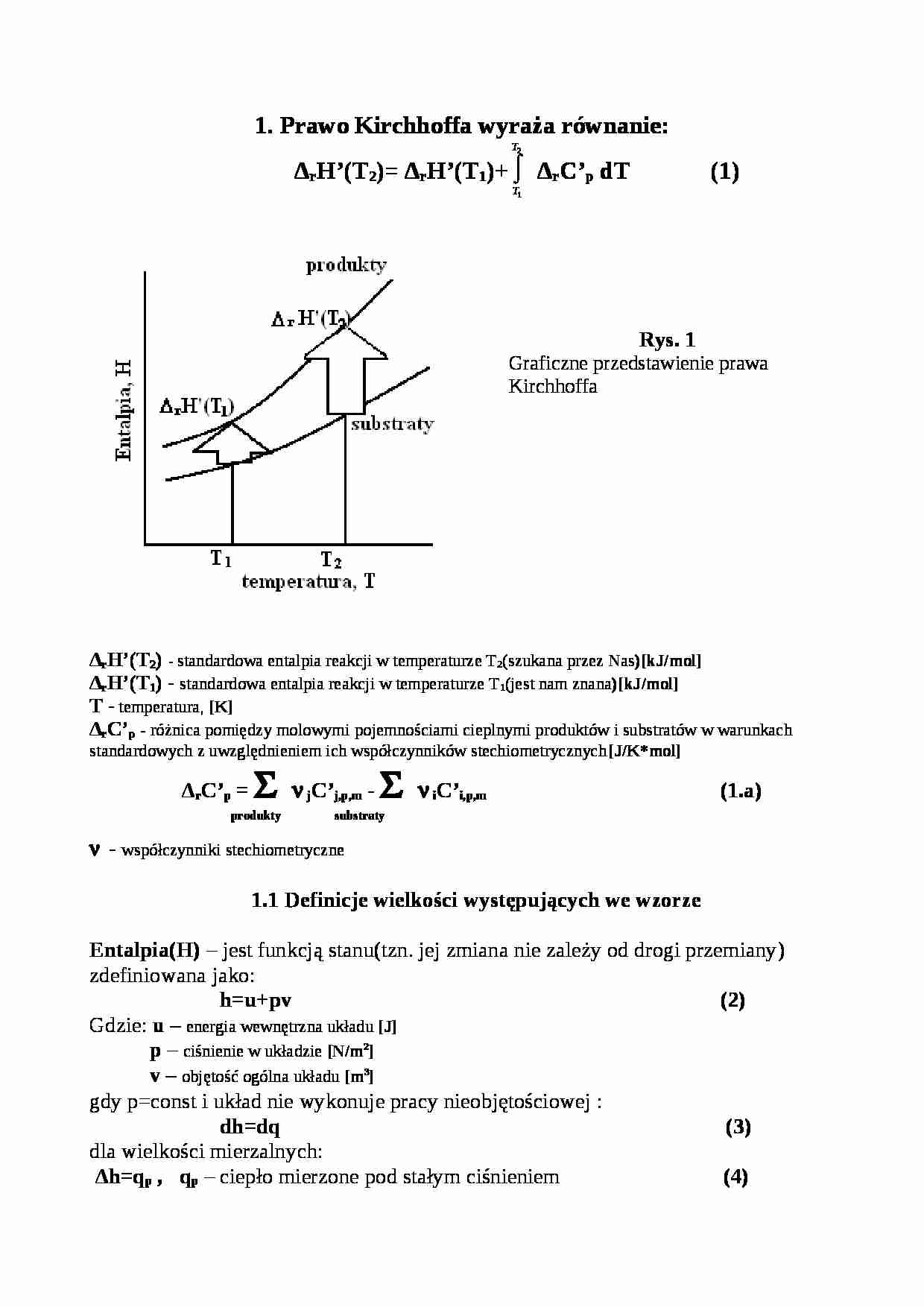
Rys. 1 Graficzne przedstawienie prawa Kirchhoffa
ΔrH'(T2) - standardowa entalpia reakcji w temperaturze T2(szukana przez Nas)[kJ/mol]
ΔrH'(T1) - standardowa entalpia reakcji w temperaturze T1(jest nam znana)[kJ/mol]
T - temperatura, [K]
ΔrC'p - różnica pomiędzy molowymi pojemnościami cieplnymi produktów i substratów w warunkach standardowych z uwzględnieniem ich współczynników stechiometrycznych[J/K*mol]
ΔrC'p = jC'j,p,m - iC'i,p,m (1.a) produkty substraty
- współczynniki stechiometryczne
Definicje wielkości występujących we wzorze
Entalpia(H) - jest funkcją stanu(tzn. jej zmiana nie zależy od drogi przemiany) zdefiniowana jako:
h=u+pv (2)
Gdzie: u - energia wewnętrzna układu [J]
p - ciśnienie w układzie [N/m2]
v objętość ogólna układu [m3]
gdy p=const i układ nie wykonuje pracy nieobjętościowej : dh=dq (3)
dla wielkości mierzalnych:
Δh=qp , qp - ciepło mierzone pod stałym ciśnieniem (4)
... zobacz całą notatkę



Komentarze użytkowników (0)