Potencjał równowagowy i charakterystyka prądowo-napięciowa elektrody cynkowej i miedzianej
Cel:
Celem ćwiczenia było wyznaczenie potencjału równowagowego ogniw cynkowego i miedziowego oraz wyznaczenie charakterystyki prądowo-napięciowej tych elektrod.
Przebieg doświadczenia:
W pierwszej części doświadczenia przygotowałyśmy roztwory ZnSO4 i CuSO4 (rozcieńczając je Na2SO4) o następujących stężeniach: 0,01M; 0,03M; 0,05M; 0,1M; 0,5M. Następnie podłączyłyśmy układ składający się z badanej elektrody (WE), czyli cynkowej lub miedziowej, elektrody odniesienia (RE) - chlorosrebrowej oraz elektrody pomocniczej (CE) - platynowej. Za pomocą takiego układu podłączonego do komputera, zmieniając jedynie stężenie roztworu, zapisywałyśmy wartości potencjału równowagowego.
W drugim etapie doświadczenia korzystałyśmy z identycznego układu pomiarowego, jednak tym razem techniką chronowoltoamperometrii cyklicznej miałyśmy za zadanie wyznaczyć charakterystykę prądowo napięciową dla analizowanych elektrod. Pomiary przeprowadzałyśmy dla stężeń 0,05M i 0,5M.
Wyniki pomiarów i ich opracowanie:
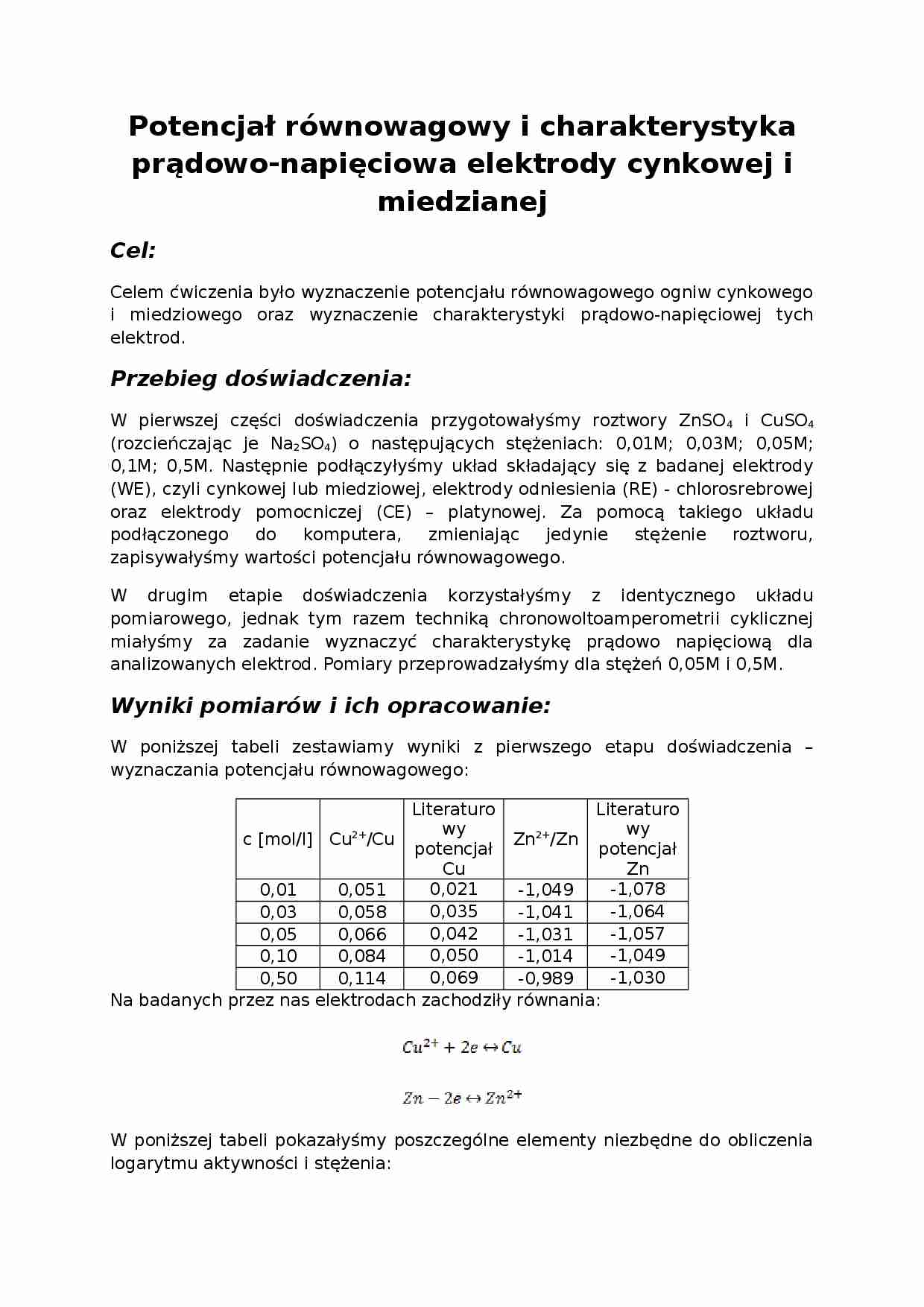
W poniższej tabeli zestawiamy wyniki z pierwszego etapu doświadczenia - wyznaczania potencjału równowagowego:
c [mol/l]
Cu2+/Cu
Literaturowy potencjał Cu
Zn2+/Zn
Literaturowy potencjał Zn
0,01
0,051
0,021
-1,049
-1,078
0,03
0,058
0,035
-1,041
-1,064
0,05
0,066
0,042
-1,031
-1,057
0,10
0,084
0,050
-1,014
-1,049
0,50
0,114
0,069
-0,989
-1,030
Na badanych przez nas elektrodach zachodziły równania:
W poniższej tabeli pokazałyśmy poszczególne elementy niezbędne do obliczenia logarytmu aktywności i stężenia:
stężenie [mol/l]
Siła jonowa
log(f2+)
f2+
aktywność [mol/l]
ln(c)
ln(a)
0,010
1,495
-1,100
0,079
0,001
-4,605
-7,138
0,030
1,485
-1,099
0,080
0,002
-3,507
-6,036
0,050
1,550
-1,109
0,078
0,004
-2,996
-5,550
0,100
1,600
-1,117
0,076
0,008
(…)
… odczytać z nich napięcie równowagowe (gdy natężenie prądu wynosi 0) poprzez ekstrapolację, co będzie przydatne do obliczenia nadnapięcia ze wzoru:
Gdzie: η - nadnapięcie, E - potencjał przy którym badamy elektrodę, Er - potencjał równowagowy.
Z powyższych wykresów wynika, iż wzrost stężenia roztworu powoduje zmniejszenie nachylenia krzywej, a więc przemiatanie potencjałem powoduje mniejsze zmiany natężenia prądu w bardziej stężonych roztworach. Dzięki wygenerowanym przez program Excel równaniom obliczyłam wartości współczynnika a oraz wartości prądu wymiany posługując się poniższym wzorem:
Gdzie: ηA - nadpotencjał anodowy, R - stała gazowa (8,314[J/mol*K]), T - temperatura (298 [K]), - współczynnik bezwymiarowy, z - ładunek jonu (2), F - stała 96485([C/mol]), i0 - prąd wymiany, iA - prąd anodowy…
... zobacz całą notatkę





Komentarze użytkowników (0)