To tylko jedna z 7 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
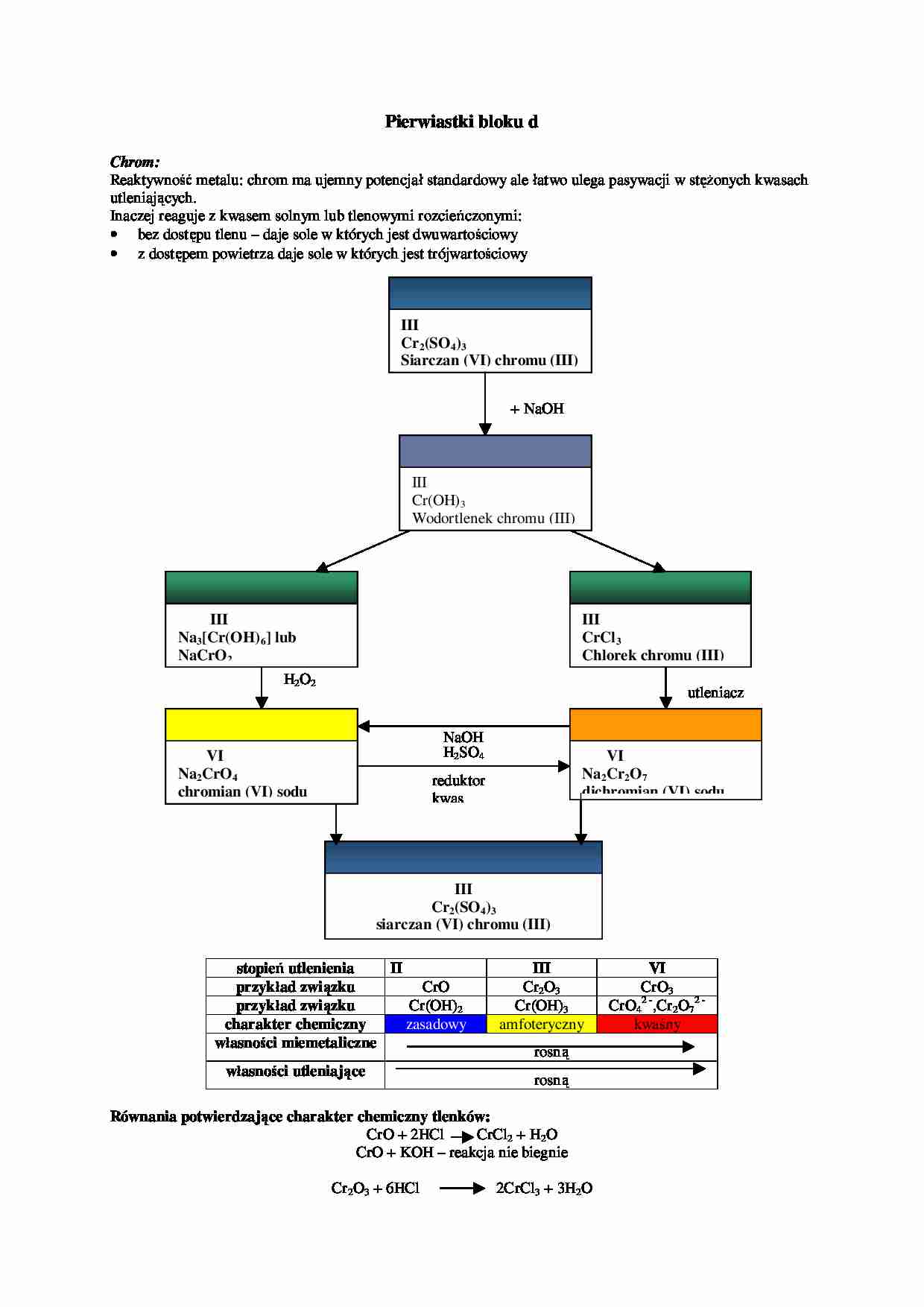


Pierwiastki bloku d Chrom: Reaktywność metalu: chrom ma ujemny potencjał standardowy ale łatwo ulega pasywacji w stężonych kwasach utleniających. Inaczej reaguje z kwasem solnym lub tlenowymi rozcieńczonymi: • bez dostępu tlenu – daje sole w których jest dwuwartościowy • z dostępem powietrza daje sole w których jest trójwartościowy stopień utlenienia II III VI przykład związku CrO Cr2O3 CrO3 przykład związku Cr(OH)2 Cr(OH)3 CrO4 2 -,Cr 2O7 2 - charakter chemiczny zasadowy amfoteryczny kwaśny własności miemetaliczne rosną własności utleniające rosną Równania potwierdzające charakter chemiczny tlenków: CrO + 2HCl CrCl2 + H2O CrO + KOH – reakcja nie biegnie Cr2O3 + 6HCl 2CrCl3 + 3H2O III Cr2(SO4)3 Siarczan (VI) chromu (III) III Cr(OH)3 Wodortlenek chromu (III) + NaOH III Na3[Cr(OH)6] lub NaCrO2 III CrCl3 Chlorek chromu (III) VI Na2CrO4 chromian (VI) sodu VI Na2Cr2O7 dichromian (VI) sodu III Cr2(SO4)3 siarczan (VI) chromu (III) H2O2 H2SO4 reduktor kwas NaOH utleniacz Cr2O3 + 6KOH + 3H2O =2K3[Cr(OH)6] CrO3 + 2KOH =K2CrO4 + H2O W środowisku kwaśnym trwałe są jony chromianowe (VI) CrO3 + HCl reakcja nie biegnie mangan: stopień utlenienia II III IV V VI VII przykład związku MnO Mn(OH)2 Mn2O3 MnO(OH) MnO2 MnO(OH)2 przykład związku MnO * Mn2O3 MnO4 3 - MnO4 2 - MnO4 - charakter chemiczny zasadowy amfoteryczny kwasowy własności niemetaliczne rosną własności utleniające rosną żelazo: ciężki metal, aktywny chemicznie, posiada właściwości ferromagnetyczne. Stosowany w hutnictwie jako główny składnik stali, żeliwa i innych stopów; także pełni funkcję katalizatora (substytut platyny). Otrzymywane w tzw. wielkim piecu podczas redukcji rud żelaza węglem i tlenkiem węgla. Proces ten jest złożony i zachodzi w kilku stadiach, przy czym następuje stopniowe przechodzenie żelaza na coraz niższy stopień utlenienia: 3 Fe2O3 + CO = 2 Fe3O4 + CO2 Fe3O4 + CO = 3 FeO + CO2 FeO + CO = Fe + CO2 II FeCl2 Chlorek żelaza (II) II Fe(OH)2 wodorotlenek żelaza (II) III Fe(OH)3 wodorotlenek żelaza (III)
(…)
…
Z
Z – liczba atomowa; numer atomu w układzie okresowym; liczba protonów w jądrze
atomowym; liczba elektronów w obojętnym atomie
A – liczba masowa; określa sumaryczną ilość protonów i neutronów w jądrze (czyli
nukleonów) A = Z + N
numer okresu w, którym znajduje się pierwiastek – liczba powłok elektronowych
numer grupy w, której znajduje się pierwiastek (dla głównych ) - liczba elektronów
walencyjnych…
…
pozyton 0 e β+ β+
+1
foton γ γ
• indeks górny cząstki to jej masa
• indeks dolny cząstki to jej ładunek
Reguła uzgadniania równań reakcji jądrowych
Suma liczb atomowych substratów jest równa sumie liczb atomowych produktów.
Suma liczb masowych substratów jest równa sumie liczb masowych produktów.
Umowny zapis procesów jądrowych
zapis pełny zapis uproszczony
1
53 2 54
Cr + r D → Mn + n 53 54
0 Cr (d,n) Mn…
…
(jądro atomu deuteru)
cząstka α
2
H
1
n
p
2
D
1 e
4
He
2 e
zapis uproszczony
d
α
β-
0
e
-1
elektron
0 e
+1
pozyton
β+
γ
foton
•
•
β-
β
β+
γ
indeks górny cząstki to jej masa
indeks dolny cząstki to jej ładunek
Reguła uzgadniania równań reakcji jądrowych
Suma liczb atomowych substratów jest równa sumie liczb atomowych produktów.
Suma liczb masowych substratów jest równa sumie liczb masowych produktów…
... zobacz całą notatkę






Komentarze użytkowników (0)