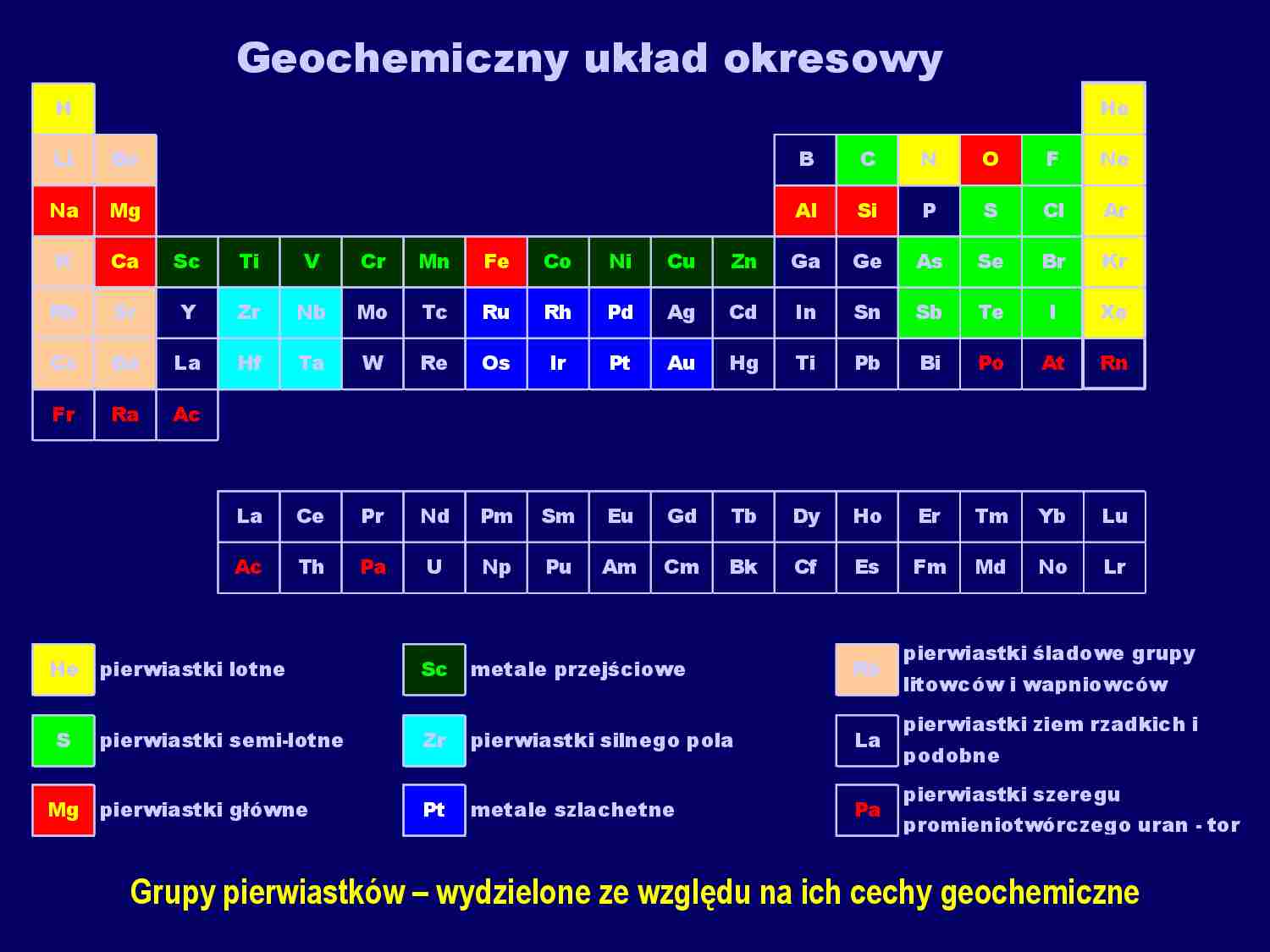


Fragment notatki:
Geochemiczny układ okresowy
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Ti
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
La
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Ac
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
He
S
Mg
pierwiastki lotne
Sc
metale przejściowe - seria I
Rb
pierwiastki semi-lotne
Zr
pierwiastki silnego pola
La
pierwiastki główne
Pt
metale szlachetne
Pa
pierwiastki śladowe grupy
litowców i wapniowców
pierwiastki ziem rzadkich i
podobne
pierwiastki szeregu
promieniotwórczego uran - tor
Grupy pierwiastków – wydzielone ze względu na ich cechy geochemiczne
Koordynacja sieciowa, Liczba koordynacyjna
Koordynacja sieciowa – opisuje, w jaki sposób dany atom
(jon) w sieci krystalicznej jest otoczony przez jony
sąsiadujące.
Liczba koordynacyjna – liczba poszczególnych jonów lub
atomów tego samego rodzaju stanowiących najbliższe
otoczenie rozpatrywanego jonu (atomu).
Schemat koordynacyjny
Schemat koordynacyjny – geometryczna konfiguracja
składników objętych liczbą koordynacyjną.
Główne typy wiązań w ciałach krystalicznych:
• wiązania jonowe (heteropolarne)
• wiązania międzycząsteczkowe
(van der Waalsa)
Promień jonowy lub atomowy -
Promień jonowy lub atomowy – wielkość przedstawiająca
z pewnym przybliżeniem strefę oddziaływania jonu (atomu)
na otaczające go w najbliższym sąsiedztwie składniki sieci
krystalicznej.
Wzajemne proporcje między promieniami jonowymi
poszczególnych składników struktury krystalicznej
przesądzają o liczbach koordynacyjnych.
Im większy promień kationu, tym większe są liczby
koordynacyjne.
Potencjał jonowy Cartledge`a
Potencjał jonowy Cartledge`a
Z
I
r
WAŻNIEJSZE PROMIENIE JONOWE PIERWIASTKÓW (wg Whittakera, Muntusa 1970)
R - promień jonowy w nm, liczby w nawiasach kwadratowych dotyczą liczby koordynacyjnej dla danej wielkości R
Promien jonowy [pm] względem ładunku
Izolinie wsp. rozdziału w układzie klinopiroksen/ciecz. Gwiazdki – Ca2+, Mg2+,
Fe2+, pierwiastki typowe dla klinopiroksenu. Pierwiaski najbliższe tym trzem
mają najwyższy współczynnik rozdziału.
Izomorfizm i rozproszenie izomorficzne pierwiastków.
Izomorfizm i rozproszenie izomorficzne
Struktury izomorficzne, struktury w których kryształy zbudowane z różnych
pierwiastków.
substancji chemicznych wykazują jednakową strukturę krystalicznej i postać
krystalograficzną. Substancje te zwane substancjami izomorficznymi
(izopostaciowymi), złożone są z atomów, jonów lub cząsteczek o podobnym
kształcie i wielkości. Substancje te mogą współkrystalizować i łatwo tworzą
roztwory stałe.
Zjawisko występowania związków chemicznych i pierwiastków w
strukturze izomorficznej określane jest jako równopostaciowość
(izomorfizm). Przykłady związków tworzących te same struktury izomorficzne:
ałuny, witriole, KH2PO4 i
(…)
… – istotną rolę
odgrywa ocean. CO2 rozpuszcza się w wodzie tworząc
najpierw słaby kwas węglowy, który następnie ulega
dysocjacji:
CO2 + H2O H2CO3 H+ + HCO3- 2H+ + CO32Zawarte w wodzie oceanicznej jony wapnia reagują z
jonami dwuwęglanu tworząc węglan wapnia:
Ca2+ + 2HCO3 CaCO3 + H2CO3
W podobny sposób węglan wapnia tworzony jest przez
różne organizmy morskie budujące sobie skorupki. Po
ich śmierci skorupki te, opadają na dno. Akumulacja
węglanu wapnia następuje na dnie stosunkowo płytkich
mórz, ponieważ na dużych głębokościach kwasowość
wody jest na tyle duża, że węglan wapnia rozpuszcza się
zanim dotrze do dna.
Wietrzenie wapieni pod wpływem wody deszczowej
zawierającej słaby kwas węglowy tworzący się w reakcji
wody z dwutlenkiem węgla zawartym w powietrzu:
CO2 + H2O H2CO3
prowadzi do powrotu…
… - zwykle 10-4 do 10-12 STP cm3/g
(czyli 10-1 do 10-9 ppm). Głównie siły van der Waalsa.
Azot – mimo, że nie jest gazem szlachetnym może się podobnie
zachowywać bo ma b. silne wiązanie N-N w azocie molekularnym
(N2) – dlatego jest go dużo w atmosferze.
Tworzy wiązania kowalentne - w stopie dominuje w formie jonu
amonowego podstawiając K+, lub jest transportowany jako fazy
1)łatwo rozpuszczalna w roztworach wodnych
2)lotna podobnie/wraz z N2. W roztworach wodnych jon amonowy jest
szybko utleniany do azotanów dominując wraz N2 – w warunkach
egzogenicznych nowe porcje jonu amonowego powstają rozkładu
związków organicznych (białek) a te powstają w roślinach w wyniku
asymilacji głównie azotanów rozpuszczonych w wodzie – stąd deficyt
azotanów w wielu naturalnych środowiskach glebowo-wodnych.
Pierwiastki semi…
… Ca2+ w plagioklazach co zubaża minerały z assocjacji (w
równowadze z Pl) w ten pierwiastek.
Promienie jonowe lantanowców (3+).
Promet - brak izotopu o półokresie rozpadu dłuższym niż 5 lat.
Promien jonowy [pm] względem ładunku
Izolinie wsp. rozdziału w układzie klinopiroksen/ciecz. Gwiazdki – Ca2+, Mg2+,
Fe2+, pierwiastki typowe dla klinopiroksenu. Pierwiaski najbliższe tym trzem
mają najwyższy…
… musi być zubożony w lekkie REE.
Ujemna anomalia Eu – dotyczy wielu skał skorupy kontynentalnej, skał osadowych i
wody morskiej. Przyczyna – skumulowanie Eu w granitoidach (plagioklazy)
powstających w głębszych partiach skorupy, stad deficyt Eu w górnej jej części.
Skały osadowe często normalizuje się do przeciętnego łupka (average shale)
Normalizacje
Wzbogacenie
w lekkie
REE
Zubożenie
w ciężkie
REE
Zubożenie…
… stopnie utlenienia
2- wyższa elektroujemność niż litowce i wapniowce – duża rola wiązania kowalencyjne
(np. S); wiązania w tlenkach i krzemianach są nadal jonowe, orbital d jest silnie
kierunkowy co implikuje preferencyjną geometrię anionów koordynacyjnych czy
ligandów.
Rozpuszczalność – zwykle słabsza niż litowców i wapniowców – bardzo zmienna i
zależy od stopnia utlenienie i obecności anionów z którymi…
... zobacz całą notatkę

Komentarze użytkowników (0)