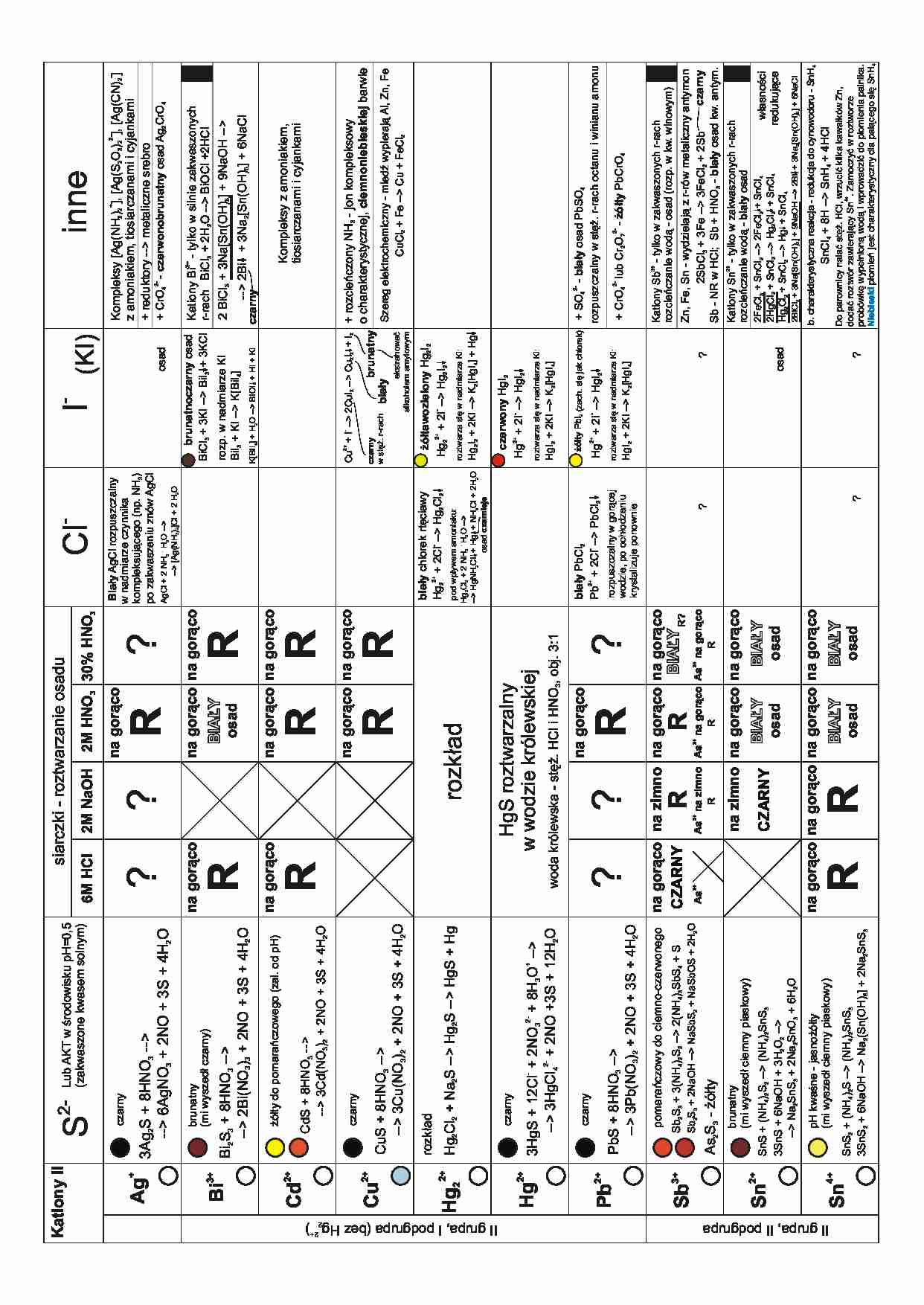
2+
Sn4+
Sn
2+
Sb3+
Pb
2+
Hg
2+
Hg2
Cu
2+
Cd
2+
Bi3+
Ag
+
Kationy II
II grupa, I podgrupa (bez Hg22+)
II grupa, II podgrupa
Lub AKT w œrodowisku pH=0,5
(zakwaszone kwasem solnym)
SnS2 + (NH4)2S -- (NH4)2SnS3
3SnS2 + 6NaOH -- Na2(Sn(OH)6] + 2Na2SnS3
pH kwaœne - jasno¿ó³ty
(mi wyszed³ ciemny piaskowy)
SnS + (NH4)2S2 -- (NH4)2SnS3
3SnS + 6NaOH + 3H2O2 --
-- Na2SnS3 + 2Na2SnO3 + 6H2O
brunatny
(mi wyszed³ ciemny piaskowy)
As2S3 - ¿ó³ty
Sb2S3 + 2NaOH -- NaSbS2 + NaSbOS + 2H2O
Sb2S3 + 3(NH4)2S2 -- 2(NH4)3SbS4 + S
pomarañczowy do ciemno-czerwonego
PbS + 8HNO3 --
-- 3Pb(NO3)2 + 2NO + 3S + 4H2O
czarny
3HgS + 12Cl- + 2NO32- + 8H3O+ --
-- 3HgCl42- + 2NO +3S + 12H2O
czarny
Hg2Cl2 + Na2S -- Hg2S -- HgS + Hg
rozk³ad
CuS + 8HNO3 --
-- 3Cu(NO3)2 + 2NO + 3S + 4H2O
czarny
CdS + 8HNO3 --
-- 3Cd(NO3)2 + 2NO + 3S + 4H2O
¿ó³ty do pomarañczowego (zal. od pH)
Bi2S3 + 8HNO3 --
-- 2Bi(NO3)3 + 2NO + 3S + 4H2O
brunatny
(mi wyszed³ czarny)
3Ag2S + 8HNO3 --
-- 6AgNO3 + 2NO + 3S + 4H2O
czarny
S
2-
?
R
R
R
HgS roztwarzalny
w wodzie królewskiej
R
na gor¹co na gor¹co
R
na gor¹co na gor¹co
BIA£Y
osad
na gor¹co na gor¹co
R
na gor¹co
2M HNO3 30% HNO3
rozk³ad
?
2M NaOH
?
R
?
R
R
CZARNY
BIA£Y
osad
BIA£Y
osad
na zimno na gor¹co na gor¹co
As3+ na zimno As3+ na gor¹co As3+ na gor¹co
R
R
R
R
R
BIA£Y
osad
BIA£Y
osad
na gor¹co na gor¹co na gor¹co na gor¹co
As3+
na gor¹co na zimno na gor¹co na gor¹co
BIA£Y R?
CZARNY
?
na gor¹co
woda królewska - stê¿. HCl i HNO3, obj. 3:1
R
na gor¹co
R
na gor¹co
?
6M HCl
siarczki - roztwarzanie osadu
-
?
?
rozpuszczalny w gor¹cej
wodzie, po och³odzeniu
krystalizuje ponownie
bia³y PbCl2
Pb2+ + 2Cl- -- PbCl2
pod wp³ywem amoniaku:
Hg2Cl2 + 2 NH3 . H2O --
-- HgNH2Cl + Hg + NH4Cl + 2H2O
osad czarnieje
bia³y chlorek rtêciawy
Hg22+ + 2Cl- -- Hg2Cl2
AgCl + 2 NH3 . H2O --
-- [Ag(NH3)2]Cl + 2 H2O
Bia³y AgCl rozpuszczalny
w nadmiarze czynnika
kompleksuj¹cego (np. NH3)
po zakwaszeniu znów AgCl
Cl
brunatny
ekstrahowaæ
alkoholem amylowym
bia³y
?
?
osad
HgI2 + 2KI -- K2[HgI4]
roztwarza siê w nadmiarze KI:
Hg2+ + 2I- -- HgI2
¿ó³ty PbI2 (zach. siê jak chlorek)
HgI2 + 2KI -- K2[HgI4]
roztwarza siê w nadmiarze KI:
czerwony HgI2
Hg2+ + 2I- -- HgI2
Hg2I2 + 2KI -- K2[HgI4] + Hg
roztwarza siê w nadmiarze KI:
¿ó³tawozielony Hg2I2
Hg22+ + 2I- -- Hg2I2
czarny
w stê¿. r-rach
Cu2+ + I- -- 2CuI2 -- Cu2I2 + I2
K[BiI4] + H2O -- BiOI + HI + KI
Kompleksy z amoniakiem,
tiosiarczanami i cyjankami
w³asnoœci
redukuj¹ce
Do parownicy nalaæ stê¿. HCl, wrzuciæ kilka kawa³ków Zn,
4+
dodaæ roztwór zawieraj¹cy Sn . Zamoczyæ w roztworze
probówkê wype³nion¹ wod¹ i wprowadziæ do p³omienia palnika.
Niebieski p³omieñ jest charakterystyczny dla pal¹cego siê SnH4
SnCl4 + 8H -- SnH4 + 4HCl
b. charakterystyczna reakcja - redukcja do cynowodoru - SnH4
2BiCl3 + 3Na[Sn(OH)3] + 9NaOH -- 2Bi + 3Na2[Sn(OH)6] + 6NaCl
2FeCl3 + SnCl2 -- 2FeCl2 + SnCl4
2HgCl2 +
... zobacz całą notatkę



Komentarze użytkowników (0)