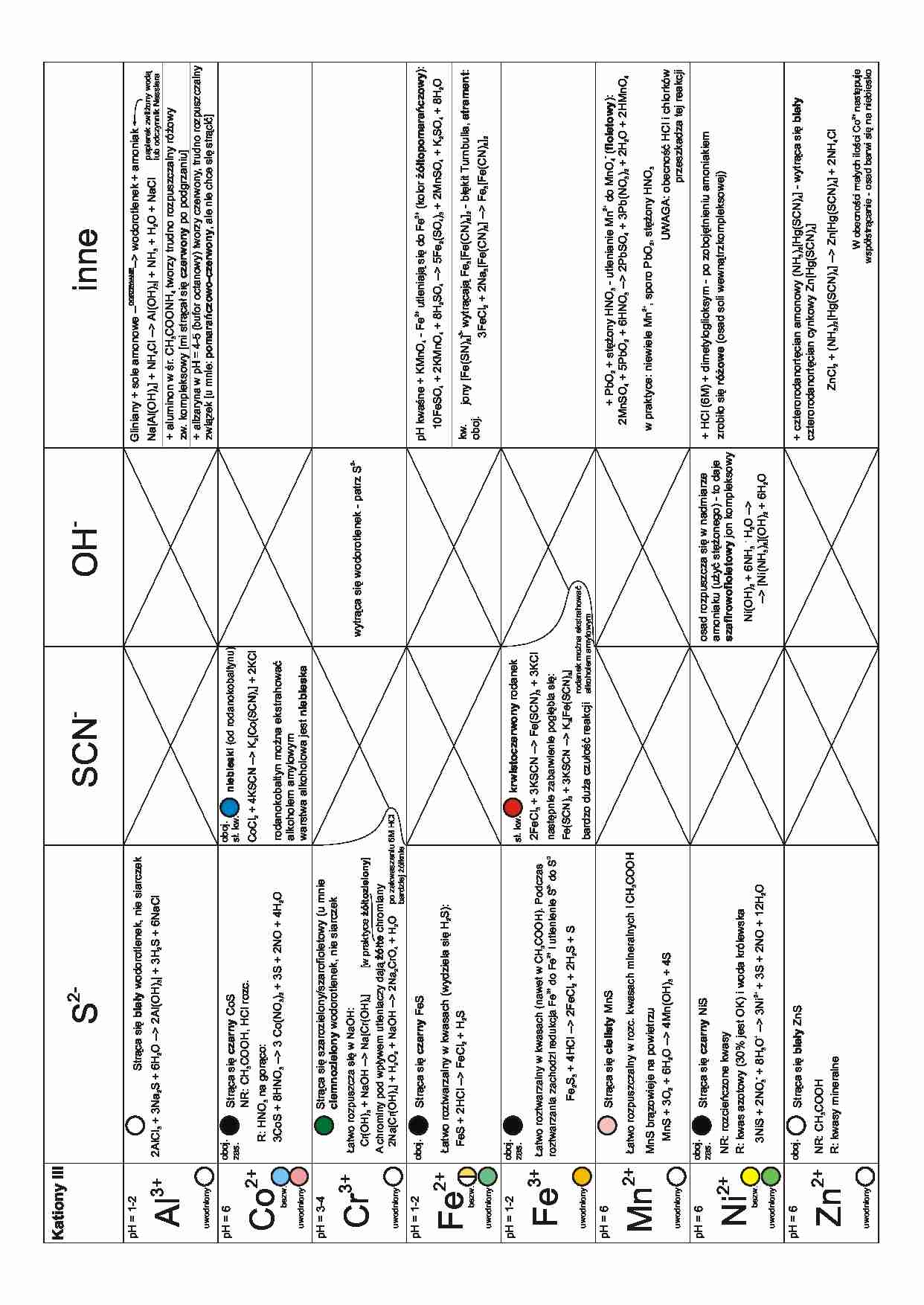
2+
3+
3+
2+
uwodniony
Zn
pH = 6
uwodniony
2+
bezw.
Ni
pH = 6
uwodniony
Mn2+
pH = 6
uwodniony
Fe
pH = 1-2
uwodniony
bezw.
Fe2+
pH = 1-2
uwodniony
Cr
pH = 3-4
uwodniony
bezw.
Co
pH = 6
uwodniony
Al3+
pH = 1-2
Kationy III
2-
Str¹ca siê czarny CoS
NR: CH3COOH, HCl rozc.
Str¹ca siê czarny FeS
bardziej ¿ó³knie
Str¹ca siê czarny NiS
Str¹ca siê bia³y ZnS
NR: CH3COOH
R: kwasy mineralne
oboj.
3NiS + 2NO3- + 8H3O+ -- 3Ni2+ + 3S + 2NO + 12H2O
NR: rozcieñczone kwasy
R: kwas azotowy (30% jest OK) i woda królewska
oboj.
zas.
MnS br¹zowieje na powietrzu
MnS + 3O2 + 6H2O -- 4Mn(OH)3 + 4S
£atwo rozpuszczalny w rozc. kwasach mineralnych i CH3COOH
Str¹ca siê cielisty MnS
Fe2S3 + 4HCl -- 2FeCl2 + 2H2S + S
£atwo roztwarzalny w kwasach (nawet w CH3COOH). Podczas
3+
2+
20
roztwarzania zachodzi redukcja Fe do Fe i utlenienie S do S
oboj.
zas.
£atwo roztwarzalny w kwasach (wydziela siê H2S):
FeS + 2HCl -- FeCl2 + H2S
oboj.
-
niebieski (od rodanokobaltynu)
SCN
bardzo du¿a czu³oœæ reakcji
OH
-
wytr¹ca siê wodorotlenek - patrz S2-
Ni(OH)2 + 6NH3 . H2O --
-- [Ni(NH3)6](OH)2 + 6H2O
osad rozpuszcza siê w nadmiarze
amoniaku (u¿yæ stê¿onego) - to daje
szafirowofioletowy jon kompleksowy
rodanek mo¿na ekstrahowaæ
alkoholem amylowym
nastêpnie zabarwienie pog³êbia siê:
Fe(SCN)3 + 3KSCN -- K3[Fe(SCN)6]
2FeCl3 + 3KSCN -- Fe(SCN)3 + 3KCl
s³. kw.
krwistoczerwony rodanek
rodanokobaltyn mo¿na ekstrahowaæ
alkoholem amylowym
warstwa alkoholowa jest niebieska
CoCl2 + 4KSCN -- K2[Co(SCN)4] + 2KCl
oboj.
s³. kw.
£atwo rozpuszcza siê w NaOH:
[w praktyce ¿ó³tozielony]
Cr(OH)3 + NaOH -- Na[Cr(OH)4]
A chrominy pod wp³ywem utleniaczy daj¹ ¿ó³te chromiany
2Na[Cr(OH)4] + H2O2 + NaOH -- 2Na2CrO4 + H2O po zakwaszeniu 6M HCl
Str¹ca siê szarozielony/szarofioletowy (u mnie
ciemnozielony wodorotlenek, nie siarczek
R: HNO3 na gor¹co:
3CoS + 8HNO3 -- 3 Co(NO3)2 + 3S + 2NO + 4H2O
oboj.
zas.
2AlCl3 + 3Na2S + 6H2O -- 2Al(OH)3| + 3H2S + 6NaCl
Str¹ca siê bia³y wodorotlenek, nie siarczek
S
W obecnoœci ma³ych iloœci Co2+ nastêpuje
wspó³str¹canie - osad barwi siê na niebiesko
ZnCl2 + (NH3)2[Hg(SCN)4] -- Zn[Hg(SCN)4] + 2NH4Cl
+ czterorodanortêcian amonowy (NH3)2[Hg(SCN)4] - wytr¹ca siê bia³y
czterorodanortêcian cynkowy Zn[Hg(SCN)4]
+ HCl (6M) + dimetyloglioksym - po zobojêtnieniu amoniakiem
zrobi³o siê ró¿owe (osad soli wewn¹trzkompleksowej)
UWAGA: obecnoœæ HCl i chlorków
przeszkadza tej reakcji
w praktyce: niewiele Mn2+, sporo PbO2, stê¿ony HNO3
+ PbO2 + stê¿ony HNO3 - utlenianie Mn2+ do MnO4- (fioletowy):
2MnSO4 + 5PbO2 + 6HNO3 -- 2PbSO4 + 3Pb(NO3)2 + 2H2O + 2HMnO4
kw.
jony [Fe(SN)6]3- wytr¹caj¹ Fe3[Fe(CN)6]2 - b³êkit Turnbulla, atrament:
oboj.
3FeCl2 + 2Na3[Fe(CN)6] -- Fe3[Fe(CN)6]2
10FeSO4 + 2KMnO4 + 8H2SO4 -- 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
pH kwaœne + KMnO4 - Fe2+ utleniaj¹ siê do Fe3+ (kolor ¿ó³topomarañczowy):
+ alizaryna w pH = 4-5 (bufor octanowy) tworzy czerwony, trudno rozpuszczalny
zwi¹zek [u mnie:
... zobacz całą notatkę



Komentarze użytkowników (0)