To tylko jedna z 11 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

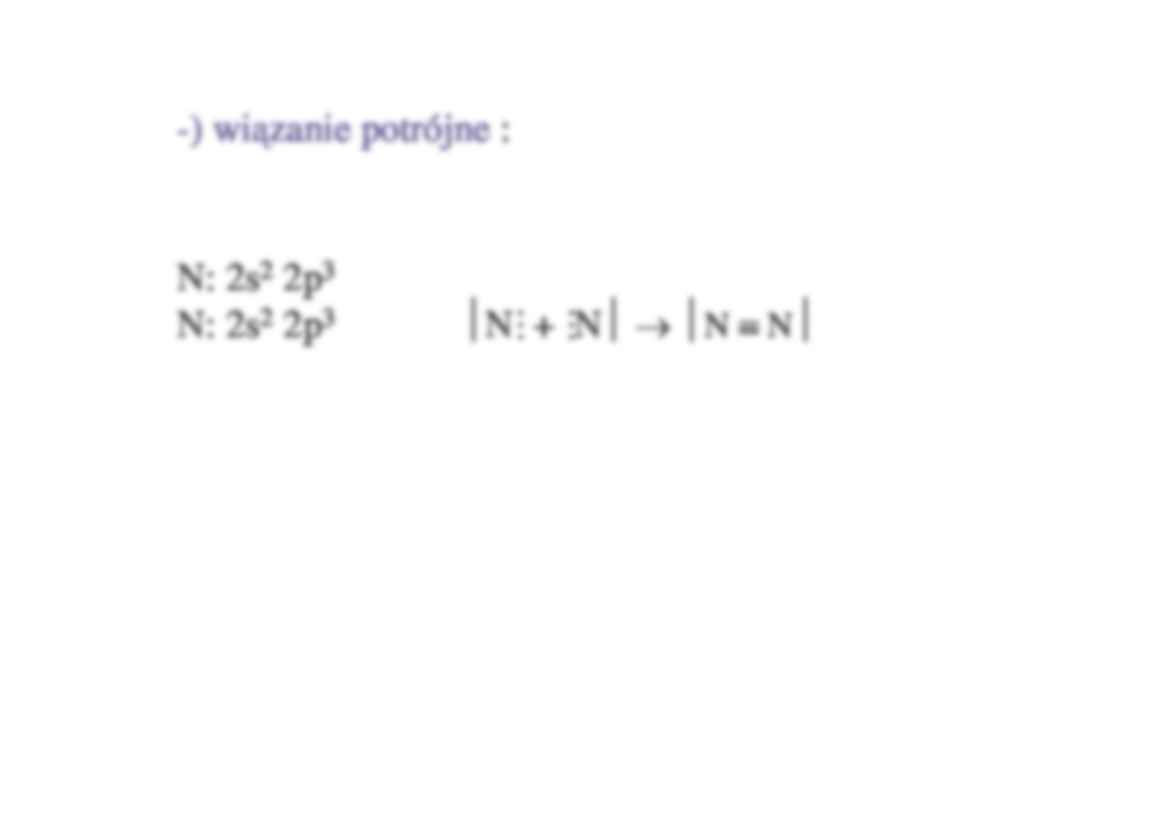
Podział wi za według wielokrotno ci
-) wi zanie pojedyncze –
H: 1s1
H: 1s1
H• + •H → H–H
-) wi zanie podwójne:
O: 2s2 2p4
O: 2s2 2p4
O: + :O → O = O
-) wi zanie potrójne :
N + N → N ≡ N
…
…
N: 2s2 2p3
N: 2s2 2p3
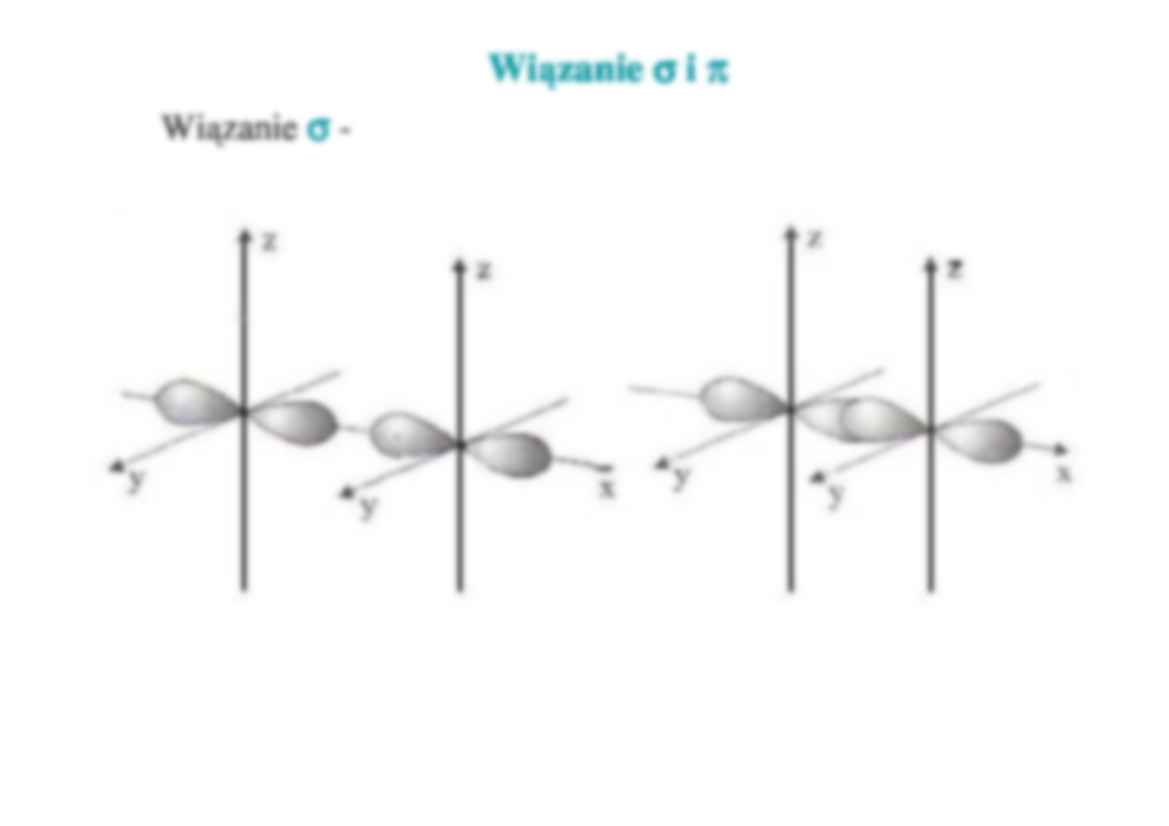
Wi zanie σ i π
Wi zanie σ -
Trwało
wi zania chemicznego
Ro nie wraz z wielokrotno ci
-) jest okre lona energi wi zania,
-) zale y od charakteru atomów zwi zanych, ale równie od
atomów s siaduj cych,
-) warto ci tabelaryczne energii rozpadu okre laj
warto energii wi zania pomi dzy atomami,
redni
Klasyfikacja reakcji chemicznych
reakcja prosta
reakcja zło ona
Kryteria podziału reakcji chemicznych
I. Wg liczby faz w mieszaninie reakcyjnej:
a) reakcja jednorodna – N2(g) + 3H2(g) → 2NH3(g)
b) reakcja niejednorodna –
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
II. Wg zewn trznych zmian podczas reakcji:
a) reakcja syntezy – z prostych substancji wchodz cych do
reakcji powstaj substancje zło one;
b) reakcja
rozkładu
(analizy) –
substancje zło one
rozpadaj si na substancje prostsze;
CaCO3(s) → CaO (s) + CO2(g)
c) reakcja podstawiania (wymiana pojedyncza) – atom
(lub grupa funkcyjna) w cz steczce substancji wchodz cej
do reakcji jest zast piony innym atomem (grup funkcyjn ).
CuSO4(aq) + Fe(s) → FeSO4(aq) + Cu(s)
d) wymiana podwójna –
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(aq)
III. Wg zmiany wi za
IV. Wg elementów bior cych udział w reakcji:
a) reakcja cz steczkowa – wszystkie reagenty reakcji s
oboj tnymi cz steczkami; 2SO2 + O2 → 2SO3
b) reakcja rodnikowa – cz steczki bior ce udział w reakcji
s rodnikami
c) reakcje jonowe – przebiegaj w rodowisku wodnym lub
w innym rodowisku polarnym;
Cu2+(aq) + Fe(s) → Fe2+(aq) + Cu(s)
V. Wg przenoszonych cz stek:
a) reakcja utleniania-redukcji – dochodzi do przeniesienia
elektronów, zmienia si stopie utlenienia;
2HICl + Zn0 → ZnIICl2 + H20
b) reakcje protolityczne (kwasowo-zasadowe) – dochodzi do
przeniesienia protonów H+;
NH3 + H2O → NH4+ + OHc) reakcje koordynujace (kompleksowe) – przeniesienie lub
rozdzielenia całych grup atomów;
CuSO4(s) + 4H2O(aq) → [Cu(H2O)4]SO4(aq)
VI. Ze wzgl du na kinetyk reakcji:
a) reakcje izolowane – przebiegaj w izolowanym układzie
b) reakcje symultaniczne (jednoczesne) – w układzie
przebiega jednocze nie kilka ró nych reakcji;
VII. Wg bilansu cieplnego:
egzotermiczne:
wydzielenie ciepła do otoczenia
endotermiczne:
pobranie ciepła z otoczenia
... zobacz całą notatkę

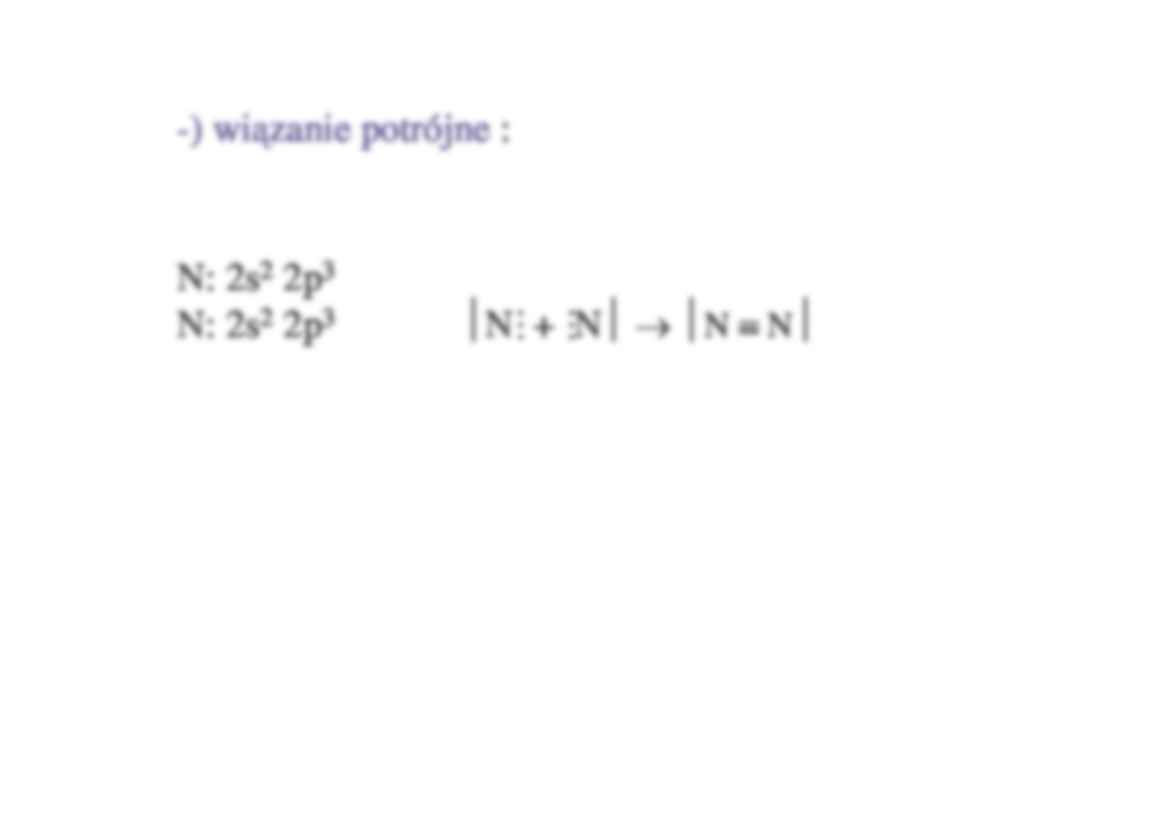



Komentarze użytkowników (0)