

Fragment notatki:
Całkowanie równań kinetycznych
Przygotował: Kamil Paduszyński
© 2010
(c) Kamil Paduszyński 2010
1
PROBLEM
Rozważamy reakcję chemiczną, np. A + 2B = C
Pytania:
● Jakie jest równanie kinetyczne dla tej reakcji?
● Jak całkować równanie kinetyczne?
● Jaki jest rząd tej reakcji?
● Jaka jest wartość stałej szybkości dla tej reakcji?
UWAGA! Wszelkie algorytmy prezentuję tylko dla stężeń molowych.
Korzystanie z nich dla układów, w których dostępne są inne parametry
(w szczególności ciśnienie) zostawiam do samodzielnego nauczenia się.
(c) Kamil Paduszyński 2010
2
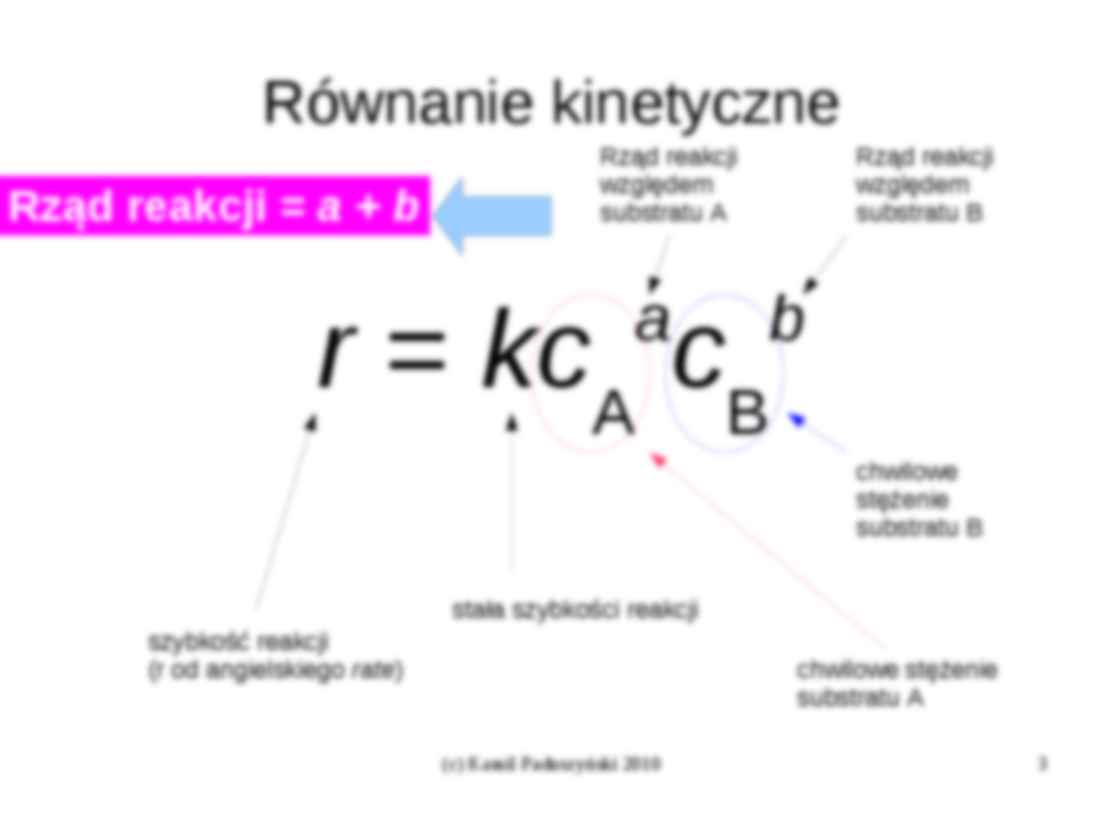
Równanie kinetyczne
Rząd reakcji = a + b
Rząd reakcji
względem
substratu A
Rząd reakcji
względem
substratu B
a
b
A B
r = kc c
chwilowe
stężenie
substratu B
stała szybkości reakcji
szybkość reakcji
(r od angielskiego rate)
chwilowe stężenie
substratu A
(c) Kamil Paduszyński 2010
3
KOMENTARZE
W równaniu kinetycznym występują tylko
chwilowe stężenia substratów (przy najmniej
w przypadkach, które analizować będziemy w
pierwszej kolejności; niedługo uciekniemy od
tego założenia)
Rząd reakcji jest SUMĄ wykładników
stojących przy chwilowych
stężeniach poszczególnych
substratów.
A a co chodzi z szybkością reakcji r?
r=
Szybkość reakcji to znormalizowana
(współczynnikiem równania reakcji)
Czasowa pochodna stężenia molowego
reagenta(substratu lub produktu) (c) Kamil Paduszyński 2010
1
dcR
υR
dt
4
Całkowanie równania kinetycznego
Zaliczenie ćwiczeń
Równanie kinetyczne: po co to?
Równanie kinetyczne podaje nam zależność stężenia
każdego z reagentów w funkcji czasu. Chwilowe stężenia są
właśnie funkcjami czasu. Funkcje są więc tutaj
niewiadomymi, bo ich znajdowaniem zajmuje się kinetyka.
Wobec tego równanie kinetyczne jest równaniem, w którym
niewiadomą jest funkcja. A jak się takie równania nazywają?
A no równaniami różniczkowymi...
Rząd reakcji
Stała szybkości
Równanie kinetyczne to równanie różniczkowe,
którego rozwiązaniem są zależności czasowe
stężeń wszystkich reagentów.
Po co rozwiązywać
równanie
kinetyczne?
Notabene: rozwiązywanie równania
różniczkowego nazywa się zwykle 5
(c) Kamil Paduszyński 2010
całkowaniem.
Całkowanie równania kinetycznego
Wymagam od Państwa umiejętności całkowania (razem z
wyprowadzeniem – odpowiedzi gotowe nie będą nawet
sprawdzane!) następujących równań kinetycznych:
r = kcA
1
a
(odpowiada reakcji A = produkty, r = -dcA/dt)
a
r = kcA c
b
B
2
(odpowiada reakcji A + B = produkty, r = -dcA/dt = -dcB/dt)
Dwa przypadki: 1) stężenia początkowe obu substratów takie
same (ławte); 2) stężenia początkowe obu substratów różne
(wprowadzenia „ubytku stężenia”; trudniejsze)
(c) Kamil Paduszyński 2010
6
Równanie
1
Rząd reakcji (mamy dany lub jest
do wyznaczenia, np. metodą
całkowo-graficzną).
r=
1
dcA
υA
dt
= kc
a
A
Warunek początkowy: cA(0) = cA0
Rozwiążmy najpierw przypadek a = 2010
(c) Kamil Paduszyński 1...
Stężenie początkowe
7
substratu A (na ogół znane)
Równanie
cA
∫
cA0
1
1
dcA
υA cA
a=1
t
= ∫ kdt
0
„czary mary”
PROSZĘ SOBIE PRZYPOMNIEĆ
CAŁKOWANIE PROSTYCH RÓWAŃ
ln cA = ln cA0 + vAkt
(c) Kamil Paduszyński 2010
8
Równanie
cA
∫
cA0
1
1
dcA
υA c
A
1 / 1
------- | ------a- 1
1 – a \ cA
a
a1
t
= ∫ kdt
0
–
1 \
-------- |
a- 1
cA0
/
(c) Kamil Paduszyński 2010
= vAkt
9
Na przykład, a = 2; reakcja A = produkty
vA = -1
1 / 1
------- | ------1 – 2 \ cA2- 1
-1
Było na
zajęciach
1 \
– -------- |
cA0 2 - 1 /
1
------–
cA
(c) Kamil Paduszyński 2010
= -kt
1
------ =
cA0
kt
10
Równanie
2
Przypadek 1:
cA0 = cB0
Reakcja: A + B = produkty
(nie będziemy rozważać innych kombinacji współczynników; dla
osób ambitnych i ciekawych pojawi się wkrótce praca
domomwa o podobnej tematyce)
cA0 = cB0 = c0
W konsekwencji
cA(t)= cB(t)= c(t)
dcA
dcB
a
b
r = – -------- = – -------- = kcA cB
dt
dt
Przy definiowaniu szybkości
wybieramy ten substrat, dla
którego mamy dane
eksperymentalne stężenia w
funkcji czasu
(c) Kamil Paduszyński 2010
POSTAĆ OGÓLNA, która w przypadku założen przypadku 1 sprowadza się do postaci11
...
Równanie
cA0 = cB0 = c0
2
W konsekwencji
Przypadek 1:
cA0 = cB0
cA(t)= cB(t)= c(t)
Zatem:
dc
a b
a+b
d
r = – -------- = kc c = kc
= kc
dt
Całkujemy teraz dokładnie tak samo jak na slajdzie 8 (lub 9, jeśli d 1).
(c) Kamil Paduszyński 2010
12
Równanie
2
Przypadek 1:
cA0 ≠ cB0
dcA
dcB
r = – -------- = – -------- = kcAcB
dt
dt
Ubytek x obu reagentów
jest taki sam *
jednakże...
x(t) = cA0 – cA(t) = cB0 - cB(t)
Stężenia nie są takie same w
dowolnej chwili czasu
(rozważamy tylko przypadek a = 1,
b = 1; ogólny przypadek jest jednak
również rozwiązywalny, ale zbyt
złożony rachunkowo)
(c) Kamil Paduszyński 2010
13
* Pod warunkiem, ze rozwazamy reakcję A + B = produkty
Np. dla reakcji 2A + B = produkty nie będzie to prawdą. Taka sama będzie współrzędna reakcji
Równanie
2
Przypadek 1:
cA0 ≠ cB0
cA(t) = cA0 – x(t)
cB(t) = cB0 – x(t)
dcA
dcB
r = – -------- = – -------- = kcAcB
dt
dt
Po podstawieniu do pochodnej okazuje się,
że -dcA/dt = -dcB/dt = dx/dt
(x jest funkcją czasu; przecież substratu jest coraz mniej z biegiem reakcji, prawda?)
(c) Kamil Paduszyński 2010
Po dokonaniu podstawień dostajemy następujące równanie:
14
Równanie
2
Przypadek 1:
cA0 ≠ cB0
dx
-------- = k(cA0 – x)(cB0 – x)
dt
Aby znaleźć zależność stężenia substratu A od
czasu należy rozwiązać powyższe równanie
(niewiadomą jest x) oraz podstawić rozwiązanie
do cA(t) = cA0 – x.
Całkujemy
przy warunku
początkowym
x(0) = 0
cA 0 – x
cA0
ln ------------- = ln -------- + (cA0 – cB0 )kt
cB 0 – x
cB0
(c) Kamil Paduszyński 2010
15
Równanie
2
Przypadek 1:
cA0 ≠ cB0
Po przekształceniu:
cA0 {exp[(cA0 – cB0 )kt] – 1}
x(t) = -------------------------------------cA0
------- exp[(cA0 – cB0 )kt] – 1
cA0
DOCELOWE
ZALEŻNOŚCI
(c) Kamil Paduszyński 2010
cA(t) = cA0 – x(t)
cB(t) = cB0 – x(t)
16
Dla ciekawych świata – wykres
Osoba, która pierwsza wyjaśni (jakościowo)
zachowanie się krzywych otrzyma 0.5 pkt.
Stężenia początkowe można odczytać z
wykresu.
(c) Kamil Paduszyński 2010
17
Dziękuję za uwagę
(c) Kamil Paduszyński 2010
18
... zobacz całą notatkę

Komentarze użytkowników (0)