To tylko jedna z 6 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
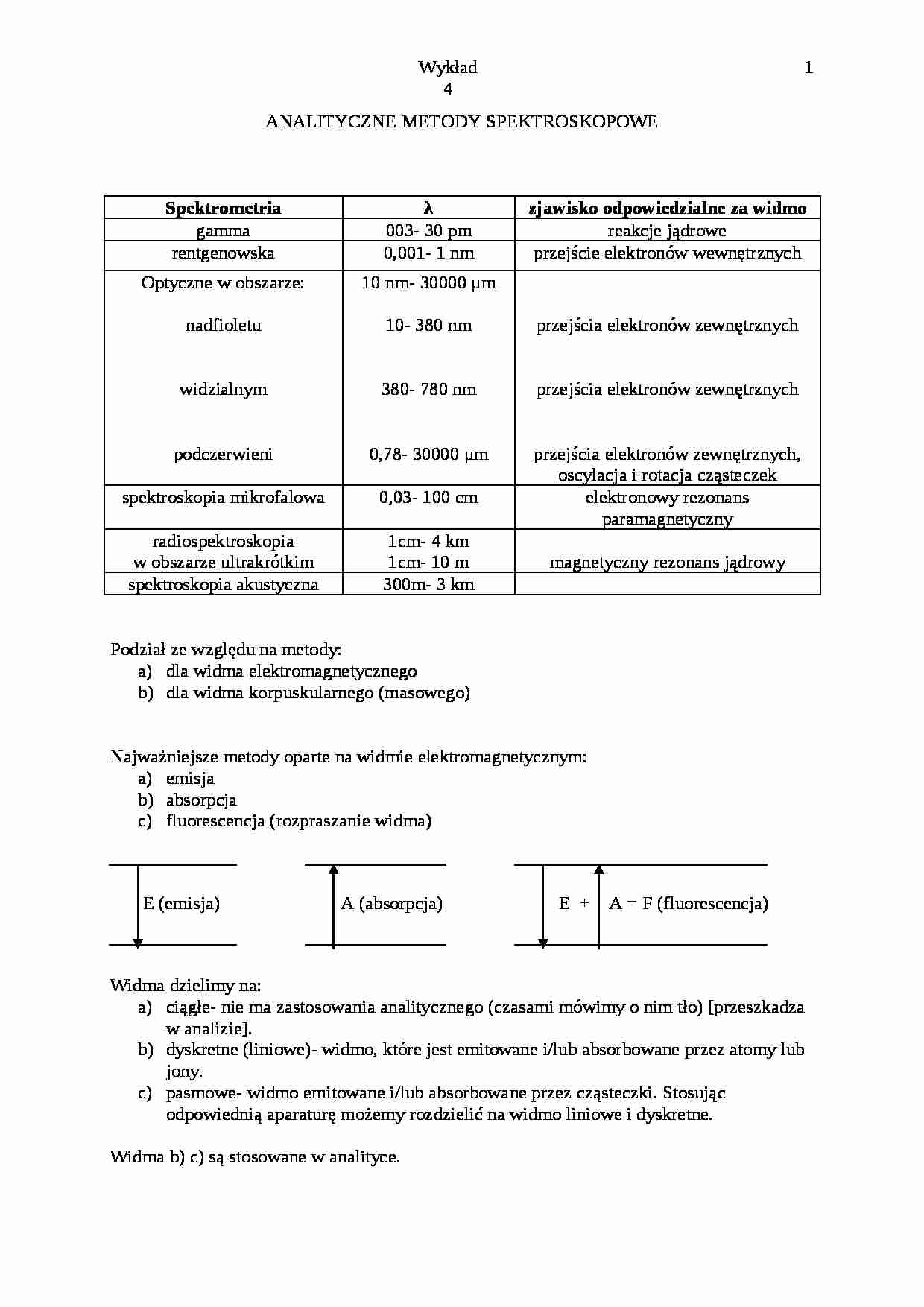


ANALITYCZNE METODY SPEKTROSKOPOWE
Spektrometria
λ
zjawisko odpowiedzialne za widmo
gamma
003- 30 pm
reakcje jądrowe
rentgenowska
0,001- 1 nm
przejście elektronów wewnętrznych
Optyczne w obszarze:
nadfioletu
widzialnym
podczerwieni
10 nm- 30000 μm
10- 380 nm
380- 780 nm
0,78- 30000 μm
przejścia elektronów zewnętrznych
przejścia elektronów zewnętrznych
przejścia elektronów zewnętrznych, oscylacja i rotacja cząsteczek
spektroskopia mikrofalowa
0,03- 100 cm
elektronowy rezonans paramagnetyczny
radiospektroskopia
w obszarze ultrakrótkim
1cm- 4 km
1cm- 10 m
magnetyczny rezonans jądrowy
spektroskopia akustyczna
300m- 3 km
Podział ze względu na metody:
dla widma elektromagnetycznego
dla widma korpuskularnego (masowego)
Najważniejsze metody oparte na widmie elektromagnetycznym:
emisja
absorpcja
fluorescencja (rozpraszanie widma)
E (emisja) A (absorpcja) E + A = F (fluorescencja)
Widma dzielimy na:
ciągłe- nie ma zastosowania analitycznego (czasami mówimy o nim tło) [przeszkadza w analizie].
dyskretne (liniowe)- widmo, które jest emitowane i/lub absorbowane przez atomy lub jony.
pasmowe- widmo emitowane i/lub absorbowane przez cząsteczki. Stosując odpowiednią aparaturę możemy rozdzielić na widmo liniowe i dyskretne.
Widma b) c) są stosowane w analityce.
Widmo emisyjne:
E' - E” = h • υ = h • c • (1/ λ) = h • c • ΰ
ΔΕ
stan stan [Ǻ]
początkowy końcowy [nm]
[μm] [cm-1]
Dla atomów:
multipletowość
( 2S+1)Lj J = L + S J = |L-S|...|L+S|
(…)
… 2P1/22P3/2 2D 2D3/2 2D5/2 3P 3P0 3P13P2 Dla cząsteczek:
kwantowa liczba orbitalna
( 2S+1)ΛΩ multipletowość, liczba wypadkowa
wielokrotność
Ω = Λ + S
Ω = |Λ - S|...| Λ+S|
S = 0 → singlet
S = 1
•
•
•
Λ = 0 Σ 1Σ 2Σ 3Σ
1 Π 2Π → 2Π1/22Π3/2 2 Δ 2Δ → 2Δ3/2 2Δ5/2 3 Φ
2Σ+4Σ- Wyróżnia się trzy sprzężenia w widmie atomowym, pięć w cząsteczkowym (Hunda).
W przypadku atomów i jonów energia wewnętrzna całkowita jest równa energii elektronów.
W przypadku cząsteczek całkowita energia wewnętrzna składa się z energii elektronowej, energii oscylacyjnej i energii rotacyjnej, jeżeli zaniedbamy energie związane z ruchem jąder.
Ewew = Eel + Eosc + Erot Eel > Eosc > Erot wiąże się z oscylacją wiąże się z rotacją
(drganiem cząsteczki)- wiąże się z (obrotem cząsteczki)
przybliżaniem i oddalaniem atomów
w cząsteczce…
… się liniami, których czas życia wynosi od 10-7 - 10-9 [s].
Zamiast posługiwać się terminem prawdopodobieństwo przejścia- posługujemy się takimi parametrami jak: moc oscylatora lub siła linii, te parametry (moc oscylatora, siła linii) stosujemy głównie w przypadku linii absorpcyjnych.
WIDMO MOLEKULARNE CZĄSTECZKOWE (pasmowe)
widmo molekularne- posługujemy się takim widmem, które odpowiada przejściom…
... zobacz całą notatkę






Komentarze użytkowników (0)