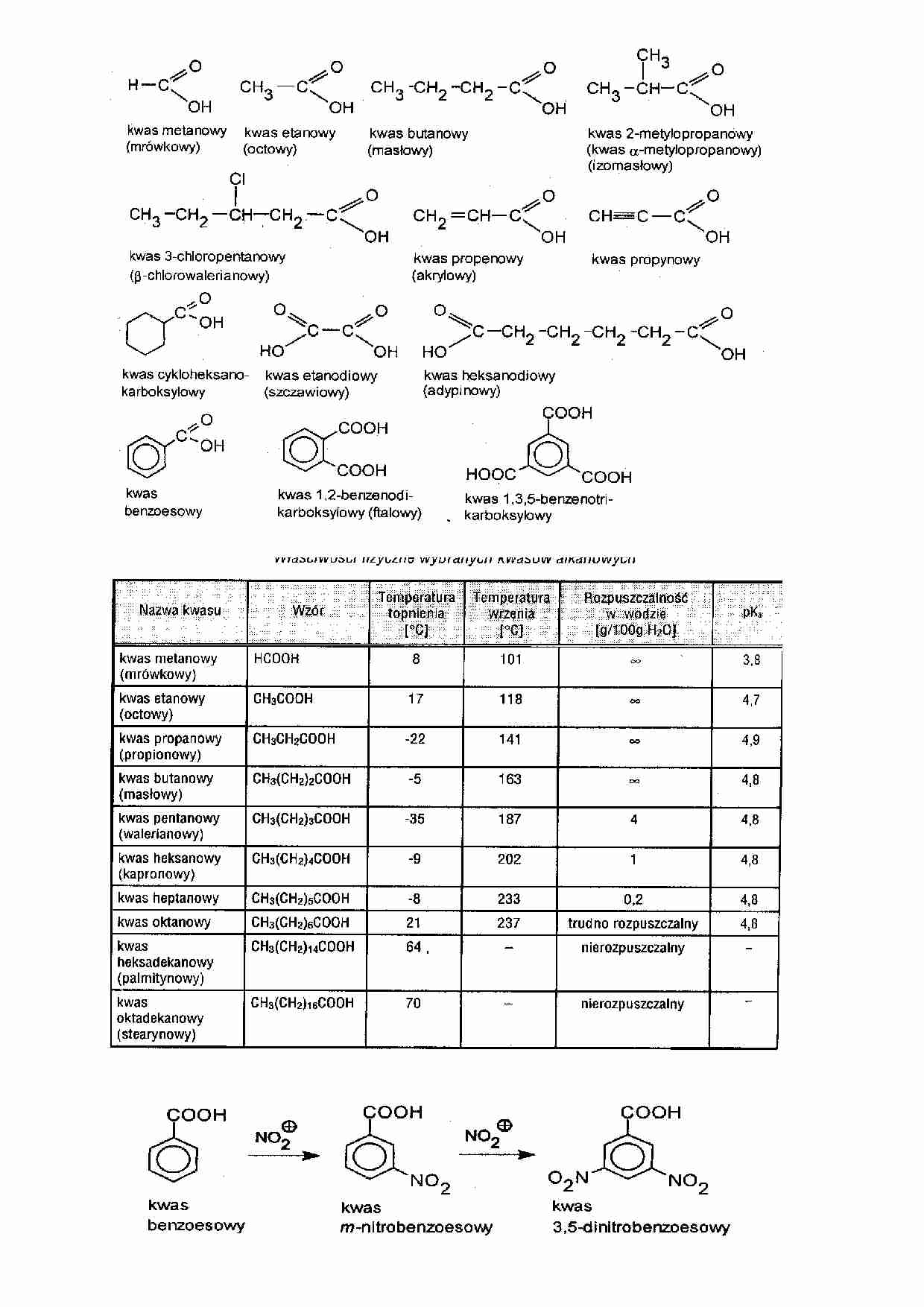
Wł.fiz . 1) temp. wrz. homologów wzrastają o 20C na każdą grupę CH2, 2) niższe kw. szeregu są ruchliwymi cieczami o ostrym zapachu(kw. propionowy), 3)next homologs.(8*C) to oleiste ciecz e o nieprzyjemnym zapachu, 4) kw. alkanokarboksylowe, aromatyczne, dikarboksylowe to ciała stałe, 5) (ogólnie)wysokie temp. wrzenia-tworzenie się dimerów połączonych wiązaniami wodoro wymi, 6) alifatyczne kw. wykazują przemienność temp. topnienia: parzysta liczba atomów węgla(high temp. topnienia), nieparzysta odwrotnie, 7) rozp.zależy od cząsteczki(grupa COOH- zmnie jsza rozp., ugrupowanie alkilowe-lepsza rozp. w niepolarnych) Otrzymywanie 1) utl. alkoholi pierwszorzędowych, aldehydów, alkenów, 2) utl. węglow. Aromat ycznych zawierających podst awniki. Gr. alkilowa utlenia się do grupy COOH., 3) hydroliza nitryli(cyjanków organ.) R-C ≡N+2H2O→R-C=O(pod C- OH) + NH3, 4) hydroliza bezwod ników kwa sowych, estrów, amidów, halogenków kwasowych, 5) fermentacja octowa- utlenianie alkoholu etylowego powietrzem pod działaniem enzymu wytwarzanego przez niektóre grzyby i bakterie: CH3-CH2 OH+O2 → CH3-C=O(pod C-OH) + H2O. . Danger kw : Mrówkowy(klasa 8(-), kat opakowania(II)), Octowy(8(3), II/III), Metakrylowy(8(-), III),Szczawiawy(6.1(-), III) Mydła . Kwasy tłuszczowe o kilku10 z NaOH lub KOH dają sole zwane mydłami: C17H35--COOH+NaOH ⇔ C17H35--COONa+H2O. (stearynian sodu). 1) różna konsystencja w zależności od użytego kwasu, oraz od użytego wodorotlenku. 2) Mydła sodowe i potasowe (sole hard kw i weak zasad) w roztw. wodnych ulegają hydrolizie i wykazują odczyn zasadowy: C17H35--COO--+H2O ⇔ C17H35--COOH+OH Wł chem .: 1) rozerwanie wiązania OH : a) dysocjacja jonowa kwasów karboksylowch roztworach wodnych: R-COOH + H2O →R-COO--+ H3O. przesunięcie pary elektronowej łączącej atom H z atomem O ułatwia odszczepienie protonu grupy karboksylowej, b) reakcje z metalami, tl. metali, wodorotlenkami- powstają sole: 2R- COOH+Zn →(R-COO)2Zn+H2 , 2R-COOH+CuO→(R-COO)2Cu+H2O , 2R- COOH+NaOH →R-COONa+H2O, c) hydroliza soli: R-COO--+ H2O→ R- COOH+OH--. 2) rozerwanie wiązania C-OH - addycja czynnika neuklofilowego do karbonylowe go atomu C, a następnie eliminacja odpowiedniego fragmentu. Prowadzą do powstawania kwasów karboksylowych, bezwodników kwasowych i estrów: R- C=O(pod C-OH) →(ROH)→ R-C=O( p...od C-OR) 3) substytucja atomów wodoru alfa oraz pierścienia aromatycznego : a) Br w obecności fosforu reaguje z kwasami alkanowymi: CH3-CH2- C=O(pod C-OH) +Br2 → CH3-CH(na d CH-Br)-C=O(pod C-OH), b) Nitrowanie kwasu
(…)
…)
+Br2→ CH3-CH(na d CH-Br)-C=O(pod C-OH), b) Nitrowanie kwasu
benzoesowego: HNO3+H2SO4→NO2++HSO4--+H2O,
4) reakcja dekarboksylacji. A)stapianie soli kwasów z wodorotlenkami miedzi
prowadzi do powstania węglowodorów nasyconych: CH3-C=O(pod C-ONa) +
NaOH→ CH4+Na2CO3, B) termiczny rozkład soli wapnia kw. karbok. - powstaj.
Ketony: (CH3COO)2Ca→ 2*CH3>C=O+C aCO3, C) dekarboksylacja termiczna
rozerwanie…
... zobacz całą notatkę





Komentarze użytkowników (0)