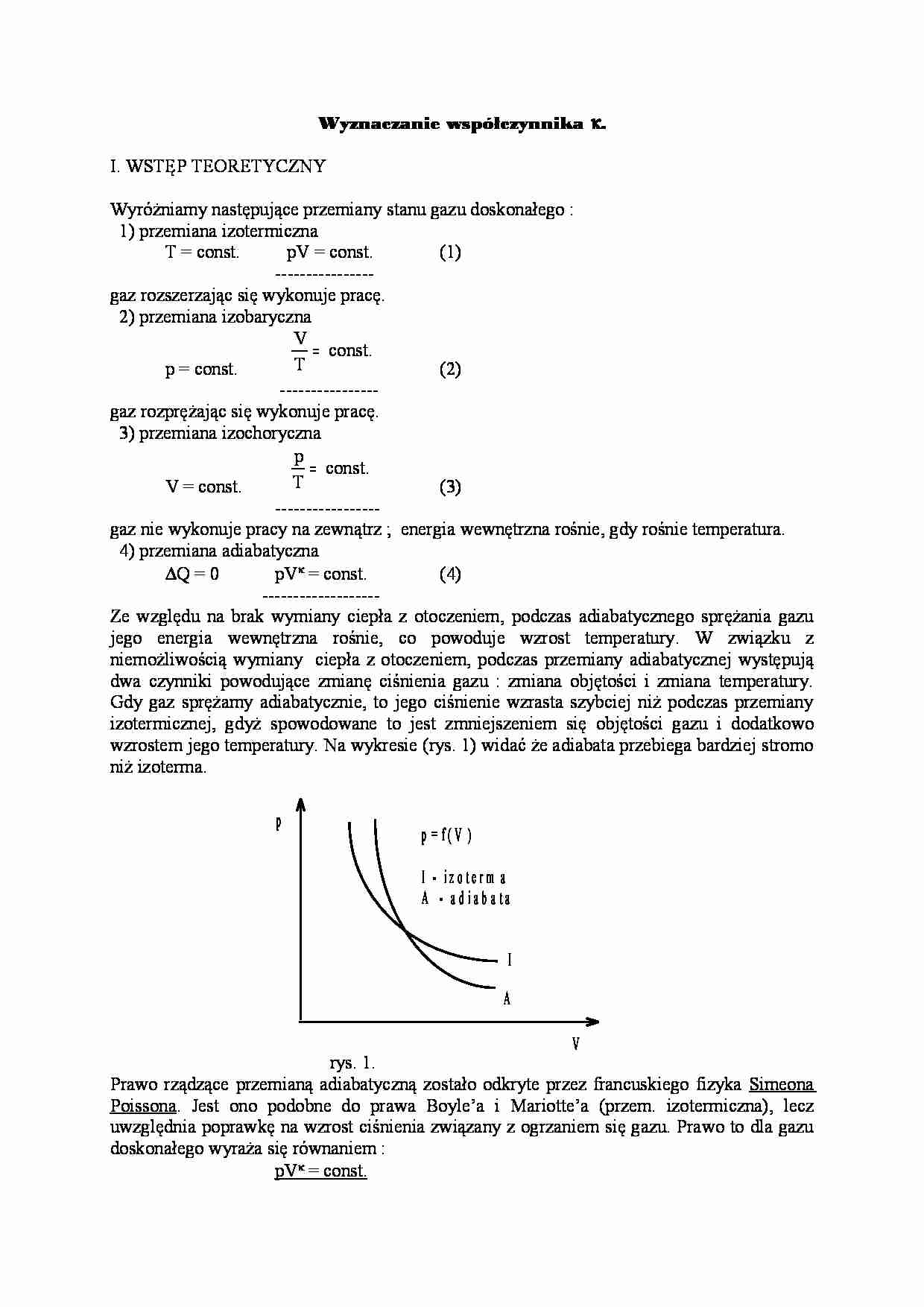
Wyznaczanie współczynnika κ. I. WSTĘP TEORETYCZNY Wyróżniamy następujące przemiany stanu gazu doskonałego : 1) przemiana izotermiczna T = const. pV = const. (1) ---------------- gaz rozszerzając się wykonuje pracę. 2) przemiana izobaryczna p = const. V T const = . (2) ---------------- gaz rozprężając się wykonuje pracę. 3) przemiana izochoryczna V = const. p T const = . (3) ----------------- gaz nie wykonuje pracy na zewnątrz ; energia wewnętrzna rośnie, gdy rośnie temperatura. 4) przemiana adiabatyczna ∆Q = 0 pVκ = const. (4) ------------------- Ze względu na brak wymiany ciepła z otoczeniem, podczas adiabatycznego sprężania gazu jego energia wewnętrzna rośnie, co powoduje wzrost temperatury. W związku z niemożliwością wymiany ciepła z otoczeniem, podczas przemiany adiabatycznej występują dwa czynniki powodujące zmianę ciśnienia gazu : zmiana objętości i zmiana temperatury. Gdy gaz sprężamy adiabatycznie, to jego ciśnienie wzrasta szybciej niż podczas przemiany izotermicznej, gdyż spowodowane to jest zmniejszeniem się objętości gazu i dodatkowo wzrostem jego temperatury. Na wykresie (rys. 1) widać że adiabata przebiega bardziej stromo niż izoterma. V p p = f ( V ) I - i z o t e r m a A - a d i a b a t a I A rys. 1. Prawo rządzące przemianą adiabatyczną zostało odkryte przez francuskiego fizyka Simeona Poissona. Jest ono podobne do prawa Boyle’a i Mariotte’a (przem. izotermiczna), lecz uwzględnia poprawkę na wzrost ciśnienia związany z ogrzaniem się gazu. Prawo to dla gazu doskonałego wyraża się równaniem : pV κ = const. gdzie κ = c p/cv - jest liczbą, którą dla gazów rzeczywistych można wyznaczyć eksperymentalnie. Również i w tym zakresie gazy wykazują duże prawidłowości i zmuszają do wiązania ich właściwości z budową cząsteczkową. Dla gazów jednoatomowych κ = 1,67 , dla dwuatomowych κ = 1,4 , dla trzyatomowych κ = 1,3 , a dla wieloatomowych sprawa się nieco komplikuje, lecz κ
(…)
… =
h − h'
oraz jej odchylenie standardowe.
2) Obliczyć maksymalny błąd κ metodą różniczki zupełnej dla wybranego pomiaru.
3) Przedyskutować wartości tych błędów.
II.WYNIKI POMIARÓW
Tabela 1.
Lp.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
h [cm]
22
19,6
20,8
18,8
19,7
17,4
23,8
20
21
19,4
κ = 1,54
S κ = 0,03385
h - h’ [cm]
13,9
12,6
15,4
13,3
12,7
10,9
14,8
12,8
13,7
11
κ
1,58
1,47
1,35
1,41
1,55
1,59
1,60
1,56…
... zobacz całą notatkę





Komentarze użytkowników (0)