To tylko jedna z 4 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Jest to sprawozdanie, istnieje już na chomiku.
"Przemiany gazowe należą do procesów termodynamicznych, w opisywaniu których znajdują zastosowanie zasady termodynamiki. Stan gazu określony jest przez podanie trzech jego parametrów: temperatury T, objętości V i ciśnienia p.
Jeżeli masa gazu pozostaje stała, wówczas wymienionych wyżej wielkości nie można zmieniać w sposób dowolny, gdyż są one ze sobą związane, tzw. Równanie stanu.
Dla gazu doskonałego równanie to nosi nazwę równania Clapeyrona i ma postać:"
"
Przemianę gazową można również zrealizować w takich warunkach, by nie dopuścić do wymiany ciepła z otoczeniem. Proces taki nosi nazwę adiabatycznego.
Wprowadzamy teraz równanie adiabaty (równanie Poissona ). Z definicji przemiany dQ = 0. Korzystając ze związków: dW = -pdV, dU = Cr dT oraz pierwszej zasady termodynamiki dU = dQ + dW, możemy zapisać:"
11 IŚ
Wyznaczanie stosunku Cp/Cr dla powietrza metodą Clementa
i Desormes'a
Ocena
Przemiany gazowe należą do procesów termodynamicznych, w opisywaniu których znajdują zastosowanie zasady termodynamiki. Stan gazu określony jest przez podanie trzech jego parametrów: temperatury T, objętości V i ciśnienia p.
Jeżeli masa gazu pozostaje stała, wówczas wymienionych wyżej wielkości nie można zmieniać w sposób dowolny, gdyż są one ze sobą związane, tzw. Równanie stanu.
Dla gazu doskonałego równanie to nosi nazwę równania Clapeyrona i ma postać:
PV=m/M∗RT
gdzie: m-masa, M-masa cząsteczkowa, R-uniwersalna stała gazowa (R=8.314 ∗ 103 J / kmol ∗ K).
Przemiana gazowa może obejmować zmianę wszystkich trzech parametrów stanu. Można jednak stworzyć takie warunki, by jeden z parametrów pozostał niezmieniony.
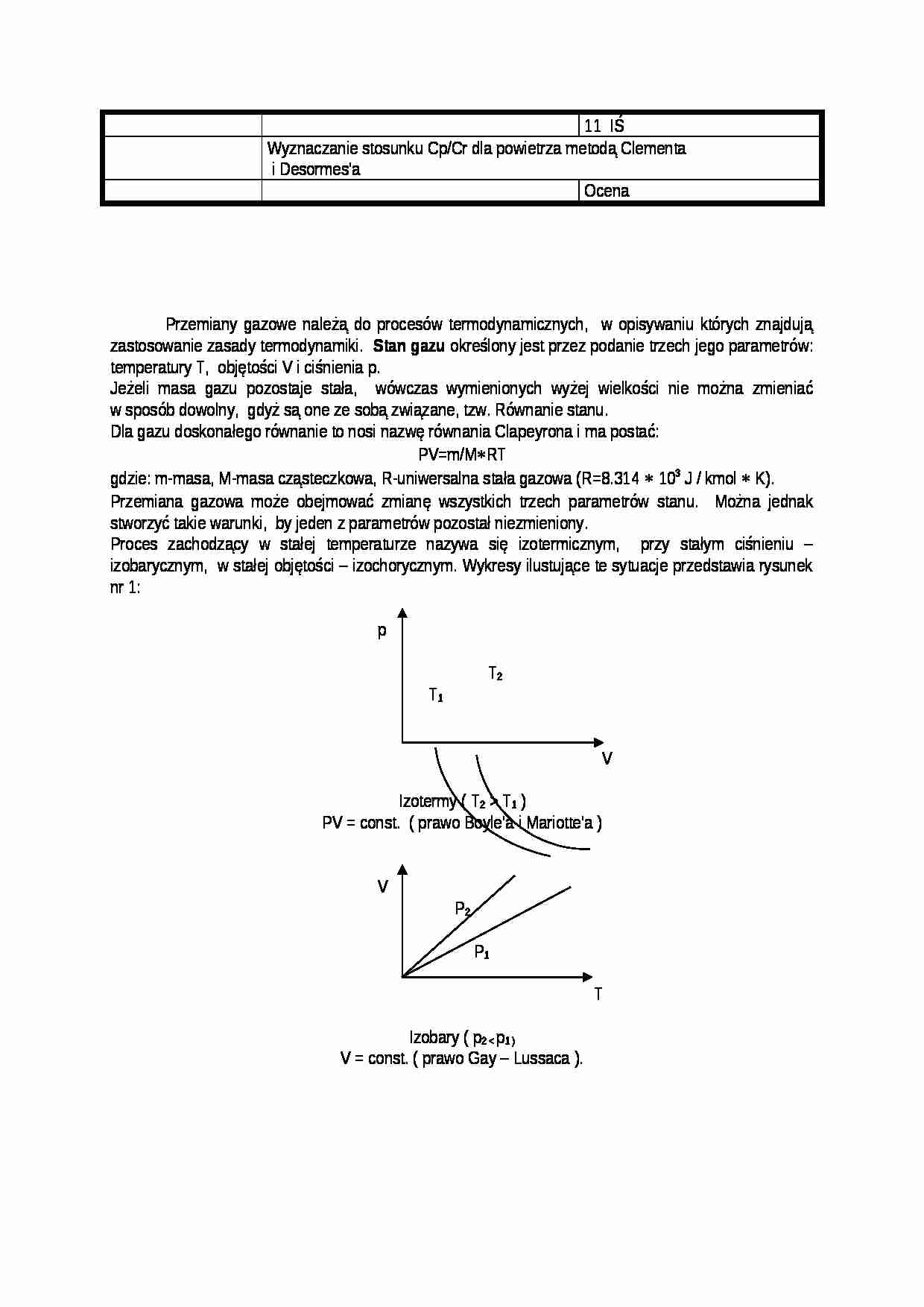
Proces zachodzący w stałej temperaturze nazywa się izotermicznym, przy stałym ciśnieniu - izobarycznym, w stałej objętości - izochorycznym. Wykresy ilustujące te sytuacje przedstawia rysunek nr 1:
p
T2
T1
V
Izotermy ( T2 > T1 )
PV = const. ( prawo Boyle'a i Mariotte'a )
V
P2
P1
T
Izobary ( p2 < p1 )
V = const. ( prawo Gay - Lussaca ).
p
V2
V1
T
Izochory ( V2 < V1 )
p = const. ∗ T ( prawo Charlesa ).
Rys. 1 Przemiany gazowe
W przemianie izotermicznej gaz rozszerzając się wykonuje pracę. Doświadczenia pokazały, że dla gazów doskonałych energia wewnętrzna zależy tylko od temperatury. Oznacza to, że przy przemianie izotermicznej energia wewnętrzna pozostaje stała, więc z pierwszej zasady termodynamiki:
(…)
… ( pojemność cieplna jednego mola gazu ).
Ponieważ w przemianie izochorycznej gaz nie wykonuje żadnej pracy, więc zgodnie z pierwszą zasadą termodynamiki ΔU = Q = Cr ΔT.
Gdy ten sam gaz chcemy ogrzać o T pod stałym ciśnieniem wówczas: Q = Cp∗ ΔT
Gaz wykonuje przy tym pracę W = -p ∗ΔV, więc pierwsza zasada termodynamiki przyjmie teraz postać: ΔU = Q - Cp ∗ΔV.
Zmiana energii wewnętrznej w obu przemianach…
… zachodzący w stałej temperaturze nazywa się izotermicznym, przy stałym ciśnieniu - izobarycznym, w stałej objętości - izochorycznym. Wykresy ilustujące te sytuacje przedstawia rysunek nr 1:
p
T2 T1 V
Izotermy ( T2 > T1 )
PV = const. ( prawo Boyle'a i Mariotte'a )
V
P2 P1 T
Izobary ( p2 < p1 ) V = const. ( prawo Gay - Lussaca ).
p
V2 V1 T
Izochory ( V2 < V1 ) p = const. ∗ T ( prawo Charlesa ).
Rys. 1…
... zobacz całą notatkę






Komentarze użytkowników (0)