WSTĘP TEORETYCZNY. Celem ćwiczenia jest wyznaczanie pojemności cieplnej i strat ciepła w kalorymetrze . Kalorymetr jest przyrządem służącym do pomiaru ilości ciepła wymienianego podczas badanego procesu .Z reguły składa się on z dwóch części : właściwego układu kalorymetrycznego , którego temperatura zmienia się w wyniku przebiegu badanego procesu , oraz otaczającego układ płaszcza . Zadaniem płaszcza jest zapobieganie wymiany cieplnej spowodowanej wpływami otoczenia lub umożliwienie dokładnego jej określenia . Niekiedy płaszcz spełnia dodatkową rolę , umożliwiając prowadzenie pomiarów w temperaturze różnej od pokojowej .Mamy następujący podział kalorymetrów :izotermiczne , tj. takie , w których cały proces biegnie w stałej temperaturze (ściślej w temperaturze bardzo zbliżonej do stałej ) ; oraz kalorymetry nieizotermiczne , w których temperatura początkowa badanego procesu w dostrzegalny sposób różni się od końcowej .
Do podstawowych metod należą : adiabatyczna ,diatermiczna i kompensacyjna .W moim ćwiczeniu skorzystałam z metody adiabatycznej .W przypadku stosowania tej metody konieczne jest ,by temperatura otaczającego płaszcza była w każdej chwili równa lub prawie równa temperaturze układu kalorymetrycznego , w których biegnie badana przemiana . Spełnienie tego warunku sprowadza wymianę cieplną pomiędzy układem a płaszczem do zera lub znacznie ją zmniejsza .
Kalorymetry adiabatyczne znajdują zastosowanie do subtelnych pomiarów małych ilości ciepła , w badaniach nad procesami długotrwałymi oraz do obserwacji efektów cieplnych towarzyszących pomiarom wykonywanym w temperaturze znacznie odbiegających od pokojowej .
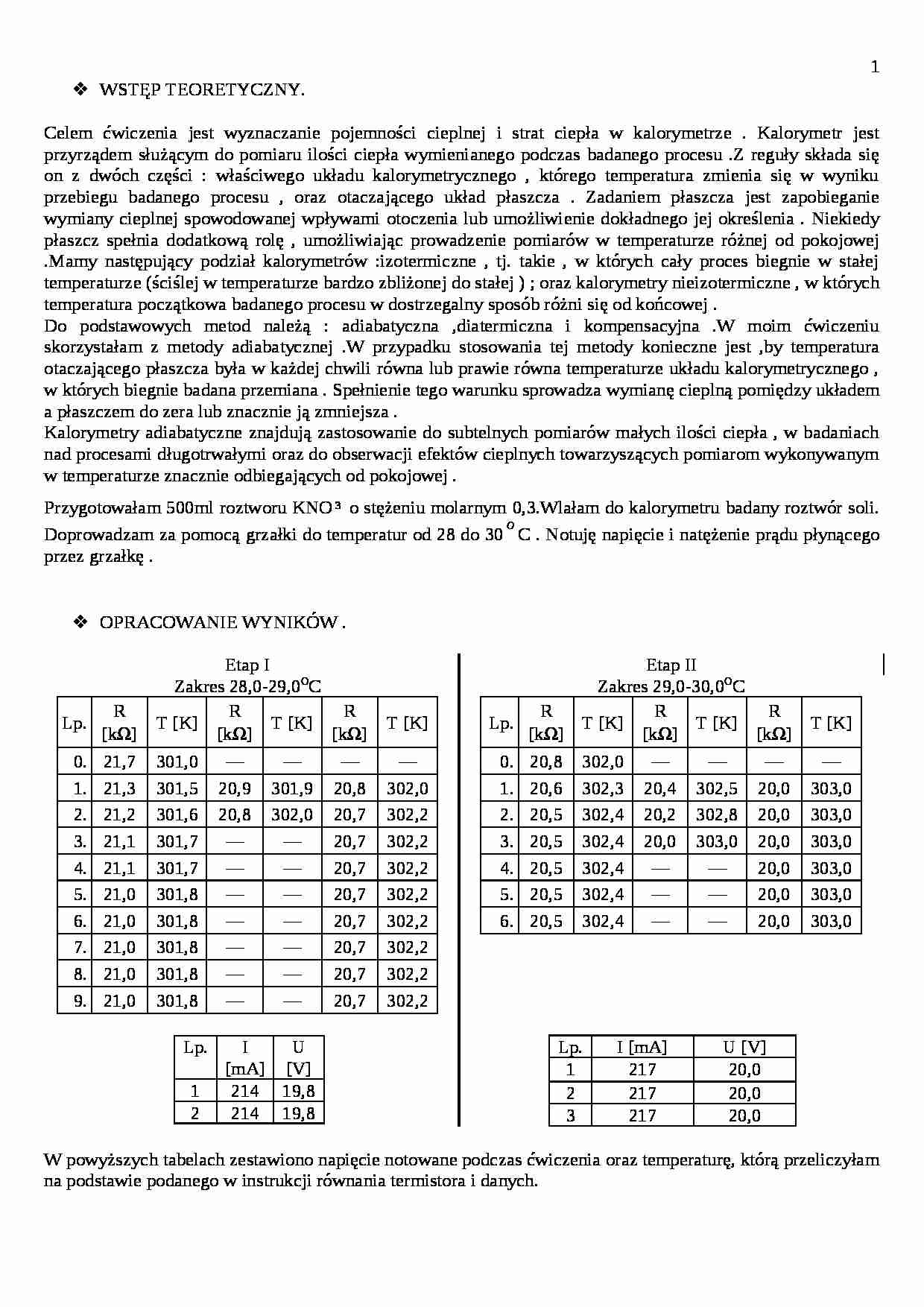
Przygotowałam 500ml roztworu KNO o stężeniu molarnym 0,3.Wlałam do kalorymetru badany roztwór soli. Doprowadzam za pomocą grzałki do temperatur od 28 do 30 C . Notuję napięcie i natężenie prądu płynącego przez grzałkę .
OPRACOWANIE WYNIKÓW .
Etap I
Etap II
Zakres 28,0-29,0 O C
Zakres 29,0-30,0 O C
Lp.
R [kΩ]
T [K]
R [kΩ]
T [K]
R [kΩ]
T [K]
0.
21,7
301,0
--
--
--
--
1.
21,3
301,5
20,9
301,9
20,8
302,0
2.
21,2
301,6
20,8
302,0
20,7
302,2
3.
21,1
301,7
--
--
20,7
302,2
4.
21,1
301,7
--
--
20,7
302,2
5.
21,0
301,8
(…)
…∞ = - 9,276298 ± 0,027936; b = 3718,57± 8,41; R - zmierzyłam opór w czasie wykonywania doświadczenia
W mniejszych tabelach podałam wartości napięcia i natężenia odnotowane w momentach wskazanych w instrukcji, o czym świadczą liczby porządkowe (Lp.).
Obliczam średnie wartości pojemności cieplnej dla etapu I i II:
U - napięcie; T - czas; ΔT- różnica temperatur; U - napięcie;
Etap I:
I= 214 [mA] = 0,214…
… powodowało i tak płynięcie prądu elektrycznego - grzałka nie wyłącza się całkowicie - powodowało to podgrzewanie się cały czas kalorymetru . Największy błąd pomiaru polega na tym , że pomiar jest wykonywany za długo . Długość powinna wpływać na dokładność pomiaru pozytywnie , lecz tak nie jest gdyż przy niedokładności przyrządów błąd popełniany ulega zwiększeniu . Dzieje się tak dlatego , że płaszcz…
... zobacz całą notatkę





Komentarze użytkowników (0)