PROTOKÓŁ Z CHEMII FIZYCZNEJ
WYZNACZANIE KRZYWEJ MIESZALNOŚCI UKŁADU DWUSKŁADNIKOWEGO
(FENOL - WODA)
Skład zespołu prowadzącego doświadczenie:
ŁUKASZ GUŁAJSKI
RAFAŁ SZCZYPIŃSKI
Ocena z przygotowania
Ocena ze sprawozdania
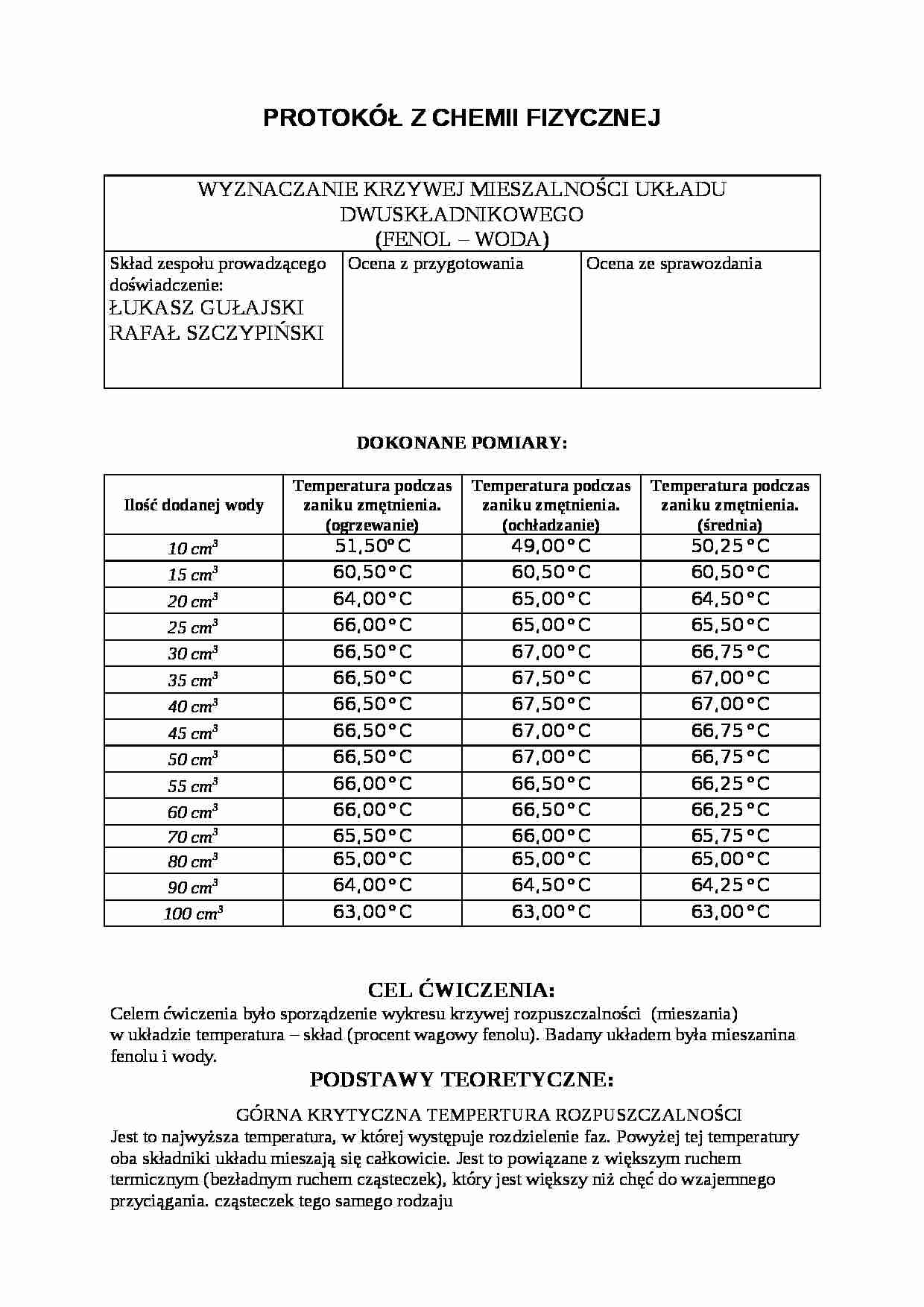
DOKONANE POMIARY:
Ilość dodanej wody
Temperatura podczas zaniku zmętnienia. (ogrzewanie)
Temperatura podczas zaniku zmętnienia. (ochładzanie)
Temperatura podczas zaniku zmętnienia. (średnia)
10 cm3
51,50o C
49,00 o C
50,25 o C
15 cm3
60,50 o C
60,50 o C
60,50 o C
20 cm3
64,00 o C
65,00 o C
64,50 o C
25 cm3
66,00 o C
65,00 o C
65,50 o C
30 cm3
66,50 o C
67,00 o C
66,75 o C
35 cm3
66,50 o C
67,50 o C
67,00 o C
40 cm3
66,50 o C
67,50 o C
67,00 o C
45 cm3
66,50 o C
67,00 o C
66,75 o C
50 cm3
66,50 o C
67,00 o C
66,75 o C
55 cm3
66,00 o C
66,50 o C
66,25 o C
60 cm3
66,00 o C
66,50 o C
66,25 o C
70 cm3
65,50 o C
66,00 o C
65,75 o C
80 cm3
65,00 o C
65,00 o C
65,00 o C
90 cm3
64,00 o C
64,50 o C
64,25 o C
100 cm3
63,00 o C
63,00 o C
63,00 o C
CEL ĆWICZENIA:
Celem ćwiczenia było sporządzenie wykresu krzywej rozpuszczalności (mieszania) w układzie temperatura - skład (procent wagowy fenolu). Badany układem była mieszanina fenolu i wody.
PODSTAWY TEORETYCZNE:
GÓRNA KRYTYCZNA TEMPERTURA ROZPUSZCZALNOŚCI
Jest to najwyższa temperatura, w której występuje rozdzielenie faz. Powyżej tej temperatury oba składniki układu mieszają się całkowicie. Jest to powiązane z większym ruchem termicznym (bezładnym ruchem cząsteczek), który jest większy niż chęć do wzajemnego przyciągania. cząsteczek tego samego rodzaju DOLNA KRYTYCZNA TEMPERATURA ROZPUSZCZALNOŚCI
Jest to temperatura, poniżej której oba składniki mieszają się w każdym stosunku, natomiast powyżej istnieją w dwóch fazach. Przykładem może być mieszanina woda / trietyloamina - w niskiej temperaturze mieszają się lepiej, ponieważ tworzą słabe kompleksy. W wysokiej temperaturze kompleksy rozpadają się i składniki mieszają się słabiej.
(…)
… mieszają się w każdym stosunku, natomiast powyżej istnieją w dwóch fazach. Przykładem może być mieszanina woda / trietyloamina - w niskiej temperaturze mieszają się lepiej, ponieważ tworzą słabe kompleksy. W wysokiej temperaturze kompleksy rozpadają się i składniki mieszają się słabiej.
ENTALPIA SWOBODNA(ENERGIA GIBBSA)
Jest to funkcja stanu wyrażona wzorem:
G = H - TS
Gdzie: H- entalpia
T- temperatura bezwzględna
S- entropia
Stanowi miarę samorzutności procesu w tych warunkach. Bez względu na skład układu reagującego przemiana zachodzi w takim kierunku, aby entalpia swobodna malała. Entalpia swobodna maleje wraz ze wzrostem temperatury i spadkiem ciśnienia. W stanie równowagi chemicznej osiąga wartość minimalna. METODY BADAŃ RÓWNOWAG CIECZ-CIECZ DLA UKŁADÓW DWUSKŁADNIKOWYCH:
Metoda objętościowa
Metoda punktu zmętnienia:
Przemienne miareczkowanie mieszaniny w termostatycznym naczyniu obydwiema substancjami
Znając skład ilościowy mieszaniny należy ogrzać ją w zamkniętym naczyniu aż do zaniku jednej z faz, po czym należ układ nieznacznie ochładzać i podgrzewać kilkakrotnie zapisując temperaturę pojawienia się i zniknięcia zmętnienia.
SPOSÓB PRZEPROWADZENIA ĆWICZENIA:
W naczyniu szklanym od pipetowaliśmy…
… o pojemności 25cm3 i 5 cm3 Gumowa gruszka
Tryskawka do acetonu
Odczynniki
ROZTWORY:
Roztwór fenolu z wodą (75% wagowych fenolu)
Woda destylowana
Aceton do przeliczeń
OBLICZENIA
Do doświadczenia zużyliśmy 25cm3 (26,20g) mieszaniny fenol-woda (25% wagowych H2O). Wynika z tego, że zużyliśmy:
Ułamek molowy liczymy ze wzoru:
obliczenia po dodaniu 10cm3 wody:
Ilość dodanej wody
Ułamek molowy fenolu
5 cm3
0,2456
10…
... zobacz całą notatkę





Komentarze użytkowników (0)