Wpływ stężenia enzymu i czasu na aktywność enzymów
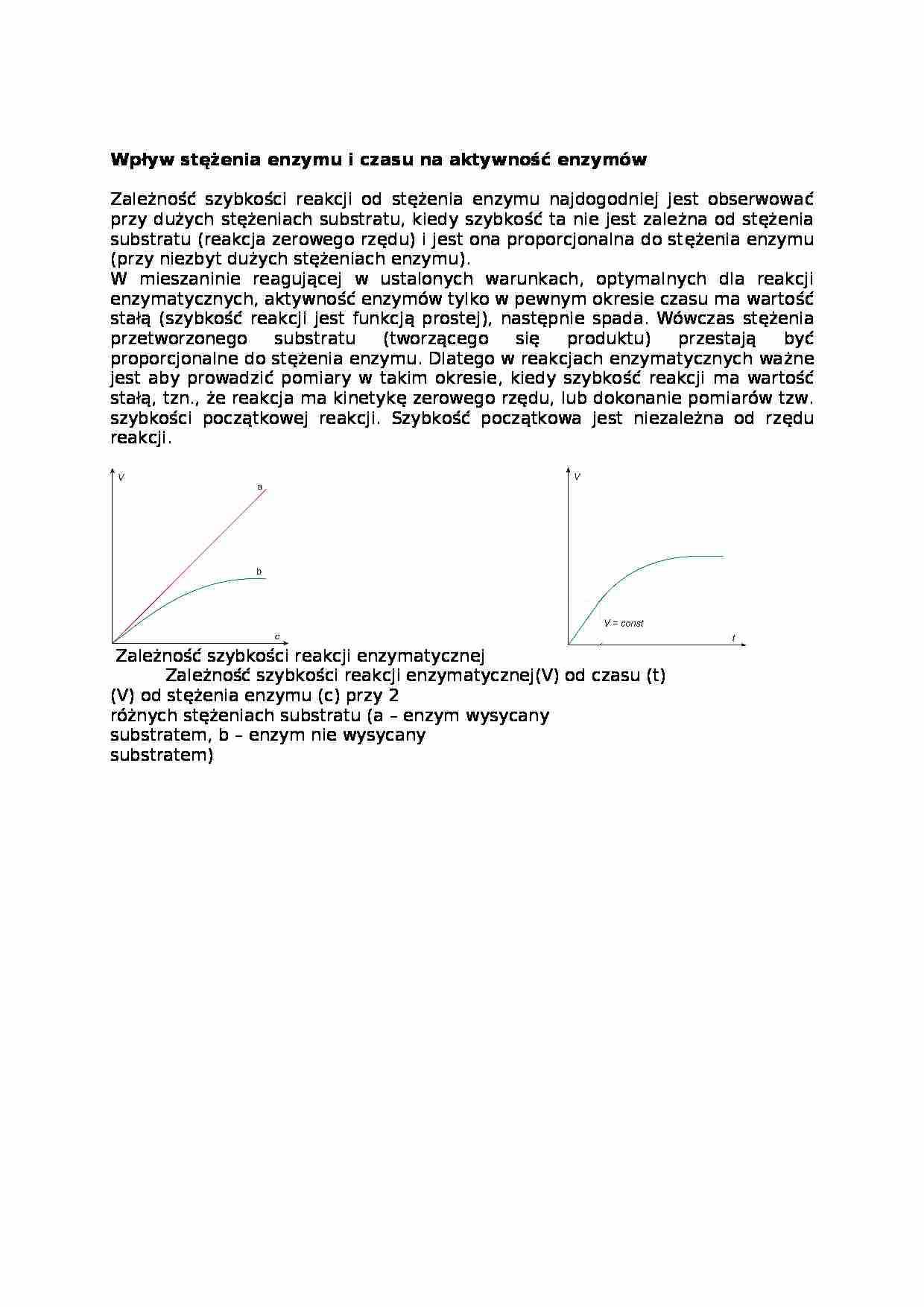
Zależność szybkości reakcji od stężenia enzymu najdogodniej jest obserwować przy dużych stężeniach substratu, kiedy szybkość ta nie jest zależna od stężenia substratu (reakcja zerowego rzędu) i jest ona proporcjonalna do stężenia enzymu (przy niezbyt dużych stężeniach enzymu).
W mieszaninie reagującej w ustalonych warunkach, optymalnych dla reakcji enzymatycznych, aktywność enzymów tylko w pewnym okresie czasu ma wartość stałą (szybkość reakcji jest funkcją prostej), następnie spada. Wówczas stężenia przetworzonego substratu (tworzącego się produktu) przestają być proporcjonalne do stężenia enzymu. Dlatego w reakcjach enzymatycznych ważne jest aby prowadzić pomiary w takim okresie, kiedy szybkość reakcji ma wartość stałą, tzn., że reakcja ma kinetykę zerowego rzędu, lub dokonanie pomiarów tzw. szybkości początkowej reakcji. Szybkość początkowa jest niezależna od rzędu reakcji.
Zależność szybkości reakcji enzymatycznej Zależność szybkości reakcji enzymatycznej(V) od czasu (t)
(V) od stężenia enzymu (c) przy 2
różnych stężeniach substratu (a - enzym wysycany
substratem, b - enzym nie wysycany
substratem)
... zobacz całą notatkę



Komentarze użytkowników (0)