To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

Monika Koziara Warszawa, 11 maja 2010
Ewelina Cieplińska
Rafał Buga
SELEKTYWNOŚĆ KATALIZATORÓW
1. Wstęp Celem ćwiczenia było dokonanie analizy wpływu trzech katalizatorów: MgO, Al2O3 oraz Cu/SiO2 na przebieg przemian alkoholu izopropylowego w dwóch różnych temperaturach: 350°C i 450°C. 2. Przebieg ćwiczenia
Ustawiono nastawę pompy infuzyjnej na określony przepływ. Po ustaleniu się temperatury 350°C, rozpoczęto dozowanie reagenta. Po czasie około 15 min. zbierano frakcję główną (15 min.). Następnie zmieniono temperaturę procesu na 450°C i postępowano w sposób analogiczny do czynności wykonywanych w temperaturze 350°C. Zbadano otrzymane próbki za pomocą chromatografu gazowego z detektorami FID
3. Część termodynamiczna
Reakcja nr 1:
2 izopropanol → eter diizopropylowy + woda
Reakcja nr 2:
izopropanol →aceton + cząst. wodoru
Reakcja nr 3:
izopropanol → propylen + woda
Reakcja
T / K
∆G˚ / kJ/mol
Kp α / % (p = 1 atm)
α / % (p = 50 atm)
1
373
3,52
0,32
53,1
53,1
573
-15,34
25,03
90,9
90,9
723
-33.43
181,58
96,4
96,4
2
373
10,03
0,04
19,8
27,9
573
-16,52
32,06
98,5
62,5
773
-43,12
819,73
99,9
97
3
373
-17,07
245,79
99,8
91,2
573
-47,21
20130
100
99,9
773
-77,5
172700
100
100
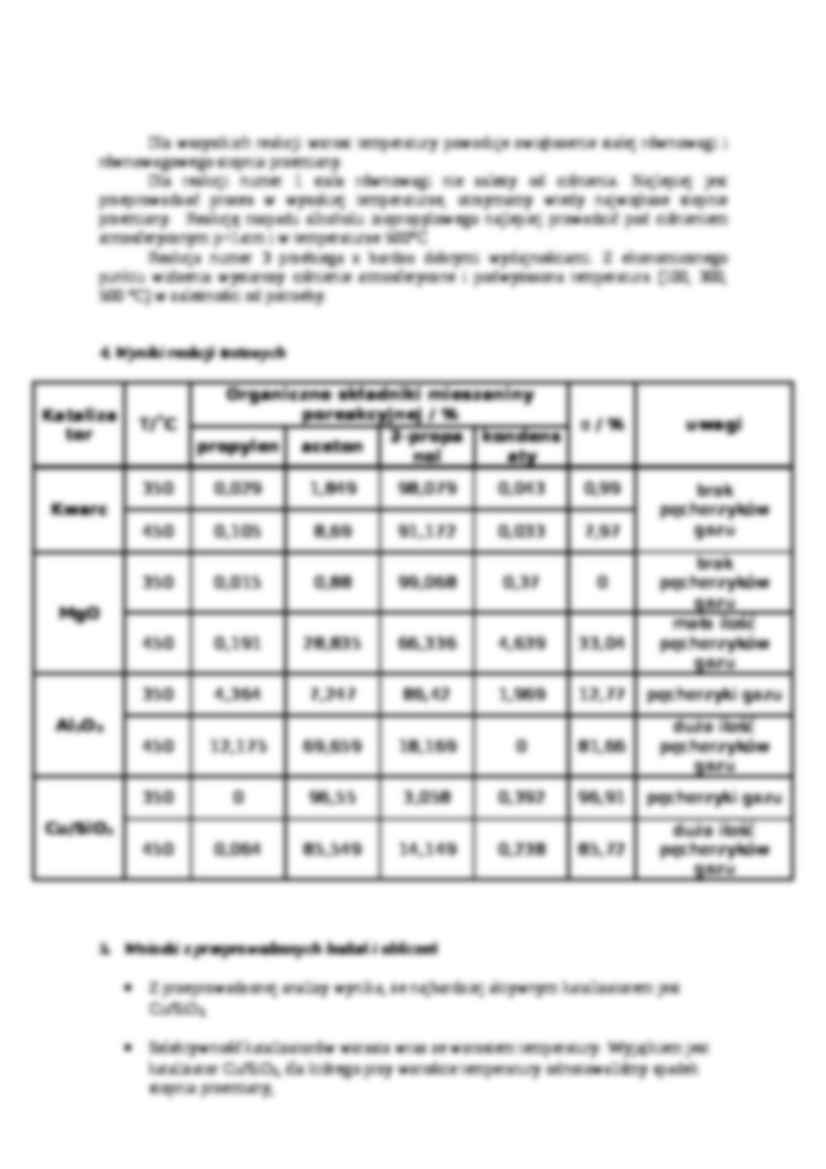
Dla wszystkich reakcji wzrost temperatury powoduje zwiększenie stałej równowagi i równowagowego stopnia przemiany. Dla reakcji numer 1 stała równowagi nie zależy od ciśnienia. Najlepiej jest przeprowadzać proces w wysokiej temperaturze, otrzymamy wtedy największe stopnie przemiany. Reakcję rozpadu alkoholu izopropylowego najlepiej prowadzić pod ciśnieniem atmosferycznym p=1atm i w temperaturze 500°C
... zobacz całą notatkę






Komentarze użytkowników (0)