

Fragment notatki:
Równowagi w roztworach
elektrolitów
ciąg dalszy
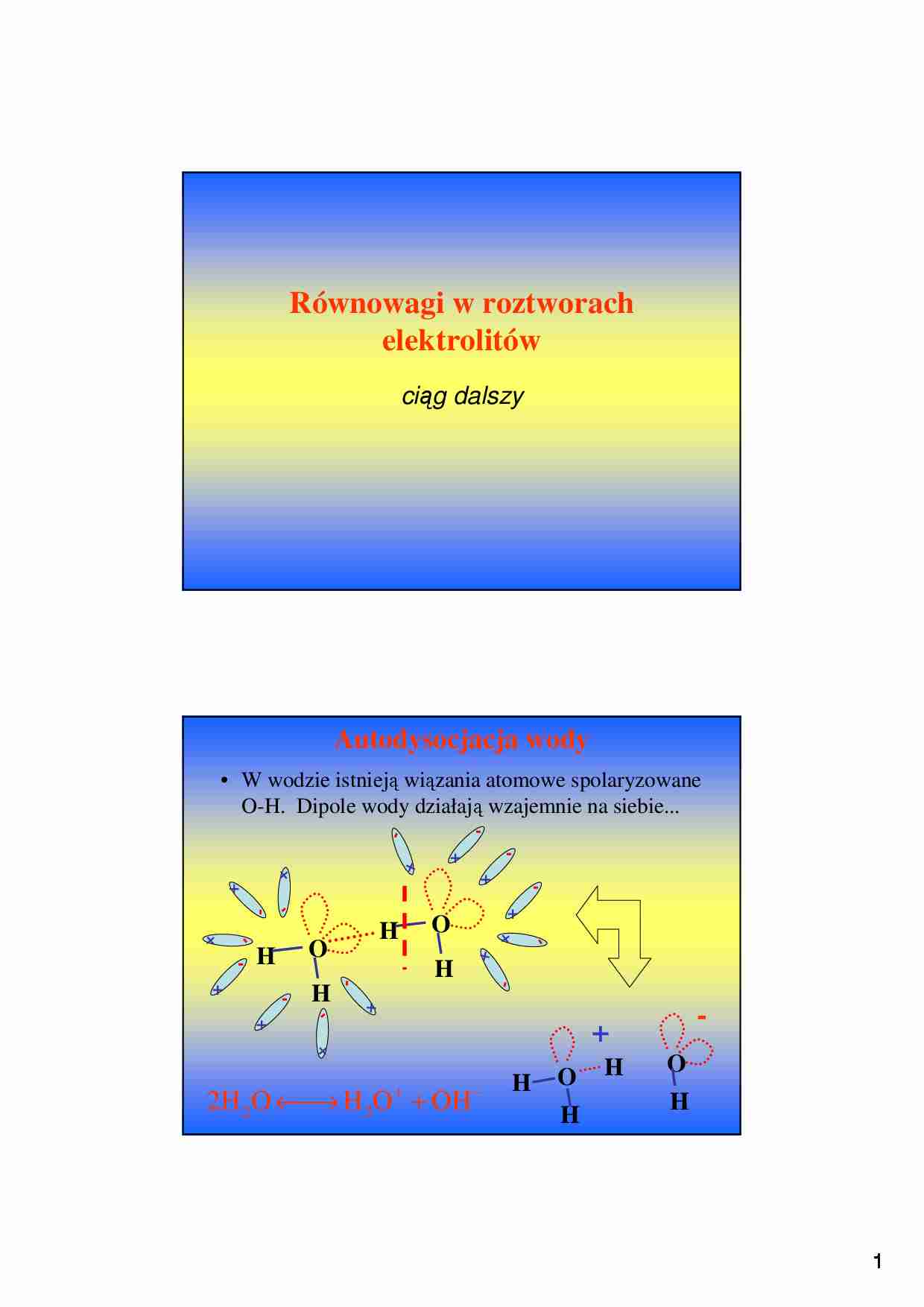
Autodysocjacja wody
• W wodzie istnieją wiązania atomowe spolaryzowane
O-H. Dipole wody działają wzajemnie na siebie...
+
-
+
+
+
-
+
-
-
+
H
H
-
-
+
O
+
+
+
-
H
-
+
-
H
O
-
+
+
2H 2O ← H 3O + + OH −
→
-
+
H
O
H
H
O
H
1
Autodysocjacja wody (2)
2H 2 O ← H 3O + + OH −
→
jon
hydroksylowy
jon
hydroniowy
Kw =
aH O + ⋅ aOH −
3
2
aH 2O
[H 3O + ] ⋅ [OH − ]
≈
[H 2 O]2
55,56
mol·dm-3
K w ⋅ [ H 2O]2 ≈ [OH − ] ⋅ [ H 3O + ] = const = k w
iloczyn jonowy wody
Iloczyn jonowy wody
][
[
]
k w = H 3O + ⋅ OH − = 10− 14 25o C
Temperatura
[°C]
10-14·kw
[
0
10
20
30
40
50
60
0,113 0,292 0,681 1,008 1,468 2,917 5,474
]
− log H 3O + = pH
[
]
− log OH − = pOH
wykładnik jonów wodorowych (Sorensen, 1909)
2
Wykładnik jonów wodorowych
• W kaŜdym roztworze wodnym
zawsze ustala się równowaga
wynikająca z autodysocjacji wody
– Jony H+ nie istnieją samodzielnie w
roztworze, gdyŜ pojedynczy proton
wytwarza bardzo silne pole elektryczne i
jest zawsze otoczony przez dipole wody
[H3O+]·[OH-] = kw =10-14
pH + pOH = pkw = 14
Równowagi w roztworach elektrolitów (II)
Kwasy i zasady (1)
Arrhenius (1887):
Kwasy - w czasie dysocjacji odszczepiają jon H+:
+
−
HR ← → H + R
W ten sposób łatwo wytłumaczyć właściwości
kwasów mineralnych i organicznych:
HCl ← → H + + Cl −
−
HNO3 ← → H + + NO3
CH 3COOH ← → H + + CH 3COO −
3
Dysocjacja wielostopniowa (Arrhenius)
• Teoria Arrheniusa pozwala równieŜ opisać wieloetapową
dysocjację kwasów wieloprotonowych:
H2
H 2CO3 ←O → H + + HCO3−
H2
HCO3− ←O → H + + CO32−
ogólnie:
H2
H n R ←O → H + + H n −1 R −
(1)
H2
H n −1 R − ←O → H + + H n − 2 R 2−
(2)
H2
H n − 2 R 2− ←O → H + + H n −3 R 3−
(3)
H2
H n R ←O → nH + + R n −
(1 + 2 + 3 ...)
Kwasy i zasady (2) (Arrhenius)
Zasady - w czasie dysocjacji odszczepiają jon OH-:
MeOH ← → Me + + OH −
W oparciu o teorię Arrheniusa moŜna łatwo wytłumaczyć
właściwości zasadowe wodorotlenków metali:
NaOH ← → Na + + OH −
Ba(OH) 2 ← → Ba 2+ + 2OH −
4
Reakcja kwasowo-zasadowa (Arrhenius)
Reakcja zobojętnienia
Reakcja zobojętnienia (kwasowo-zasadowa) polega
na wytworzeniu z pary jonów H+ (H3O+) i OH- słabo
zdysocjowanej cząsteczki wody:
HR + MeOH → MeR ( sól ) + H 2 O
H + + R - + Me + + OH - → Me + + R - ( sól ) + H 2 O
HCl + NaOH → NaCl( sól ) + H 2O
H + + Cl - + Na + + OH - → Na + + Cl - ( sól ) + H 2 O
H + + OH − → H 2 O
(H 3O + + OH − → 2H 2 O)
Teoria Arrheniusa nie pozwala wyłumaczyć
właściwości niektórych cząsteczek i jonów ...
Roztwory kwaśne i zasadowe
♥Jeśli [H3O+] [OH-], czyli pH7, a roztwór
ma odczyn zasadowy
♥Jeśli [H3O+] = [OH-], czyli pH=7, a roztwór
ma odczyn obojętny
5
Kwasy i zasady (4)
J.N.Brønsted - T.M Lowry (1923):
Kwasy - w reakcji oddają proton (są
donorami protonów)
Zasady - w reakcji przyjmują proton
(są akceptorami protonów)
Johannes
(…)
…
mozliwe stęŜenie (w danej temperaturze)
Rozpuszczalnością związku nazywamy
stęŜenie roztworu nasyconego
Roztwór nasycony pozostaje zazwyczaj w
stanie równowagi ze swoim osadem (dotyczy
związków trudno rozpuszczalnych w wodzie)
rozpuszczalnoś
Iloczyn rozpuszczalności
AB( s ) ← → A + + B −
zgodnie z zasadami pisania stałych równowagi, uznajemy
stęŜenie (aktywność) substancji stałej (czysta faza…
… x ) 2 ⋅ (3x ) 3 = 108 ⋅ x 5
x=
5
L
108
rozpuszczalnoś rozpuszczalność
Iloczyn rozpuszczalności a rozpuszczalność (3)
AB3( s ) ← → A3+ + 3B −
L = [ A3+ ] ⋅ [ B − ]3 = x ⋅ (3x ) 3 = 27 x 4
x=
4
L
27
22
Wspó
rozpuszczalność
Wspólny jon a rozpuszczalność
Jeś
się
Jeśli po ustaleniu się równowagi do roztworu nasyconego soli trudno
rozpuszczalnej dodamy elektrolitu dobrze rozpuszczalnego o jonie
wspó…
…
0,00156
0,0133
0,0001
0,1
0,00376
0,0133
cm
cs
0,1
Roztwory buforowe
Roztwory buforowe mają zdolność
utrzymywania pH roztworu na stałym poziomie
(w przybliŜeniu).
Składają się one z jednej lub kilku substancji, w
których istniejąca równowaga dysocjacji niweluje
dodatek silnego kwasu lub zasady.
Przykłady:
- mieszanina słabego kwasu i jego soli z mocną
zasadą (np. CH3COOH i CH3COONa);
- mieszanina słabej zasady i jej soli z mocnym
kwasem (np. NH4OH i NH4Cl);
- niektóre sole (np. CH3COONH4);
- mieszanina dwóch soli (np. KH2PO4 i K2HPO4).
11
Mechanizm działania roztworu buforowego
Bufor octanowy składa się z kwasu octowego
i jego soli z mocną zasadą:
CH 3COOH + H 2O ← CH 3COO − + H 3O +
→
CH 3COONa CH 3COO − + Na +
→
Kwas octowy jest elektrolitem słabym – jest zdysocjowany
częściowo, a sól – elektrolitem mocnym i zdysocjowanym
całkowicie. Zatem biorąc pod uwagę efekt wspólnego jonu
moŜna napisać w przybliŜeniu:
cCH COO − = cSÓL ;
cCH3COOH = cKWAS
3
KCH3COOH =
cH O + ⋅ cCH COO −
3
3
cCH3COOH
≈
cH O + ⋅ cSÓL
3
cKWAS
Mechanizm działania roztworu buforowego(2)
cH O + ≈
3
cKWAS
⋅ KCH3COOH
cSÓL
c
pH ≈ pK CH COOH + log SÓL
3
cKWAS
Jeśli dodamy mocnego kwasu (przybywa jonów H3O…
… i mocnych zasad? Zasadowy ???
Dysocjacja wodorowęglanu sodowego NaHCO3:
−
NaHCO 3 → Na + + HCO3
Dysocjacja kwasu węglowego:
+
−
3
K1 =
−
2
HCO 3 ← H 3O + + CO 3 −
→
K2 =
H 2 CO 3 ← H 3O + HCO
→
K1=4,3·10-7
K2=5,6·10-11
aH O + ⋅ aHCO −
3
3
aH 2CO3
aH O + ⋅ aCO 2−
3
3
aHCO −
3
17
Hydroliza soli (8)
Przypadki skomplikowane
−
dysocjacja
−
H 2 CO 3 + OH ← → HCO3 + H 2 O ← → H 3O + + CO 2−
3…
…
− 6 = 10
[OH ]
10
Obecność wspó
obniŜ
rozpuszczalność
Obecność wspólnego jonu obniŜa w tym przypadku rozpuszczalność
rzę
wodorotlenku Ŝelaza (III) o 18 rzędów !
23
rozpuszczalność
„Obcy” jon a rozpuszczalność
Obcy”
• Czy dodatek soli, która nie ma wspólnego jonu
z osadem zmienia rozpuszczalność soli ?
• Tak, gdyŜ zmianie ulega siła jonowa roztworu
– zmienia się zatem (zgodnie z prawem
Debeye’a…
... zobacz całą notatkę

Komentarze użytkowników (0)