To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
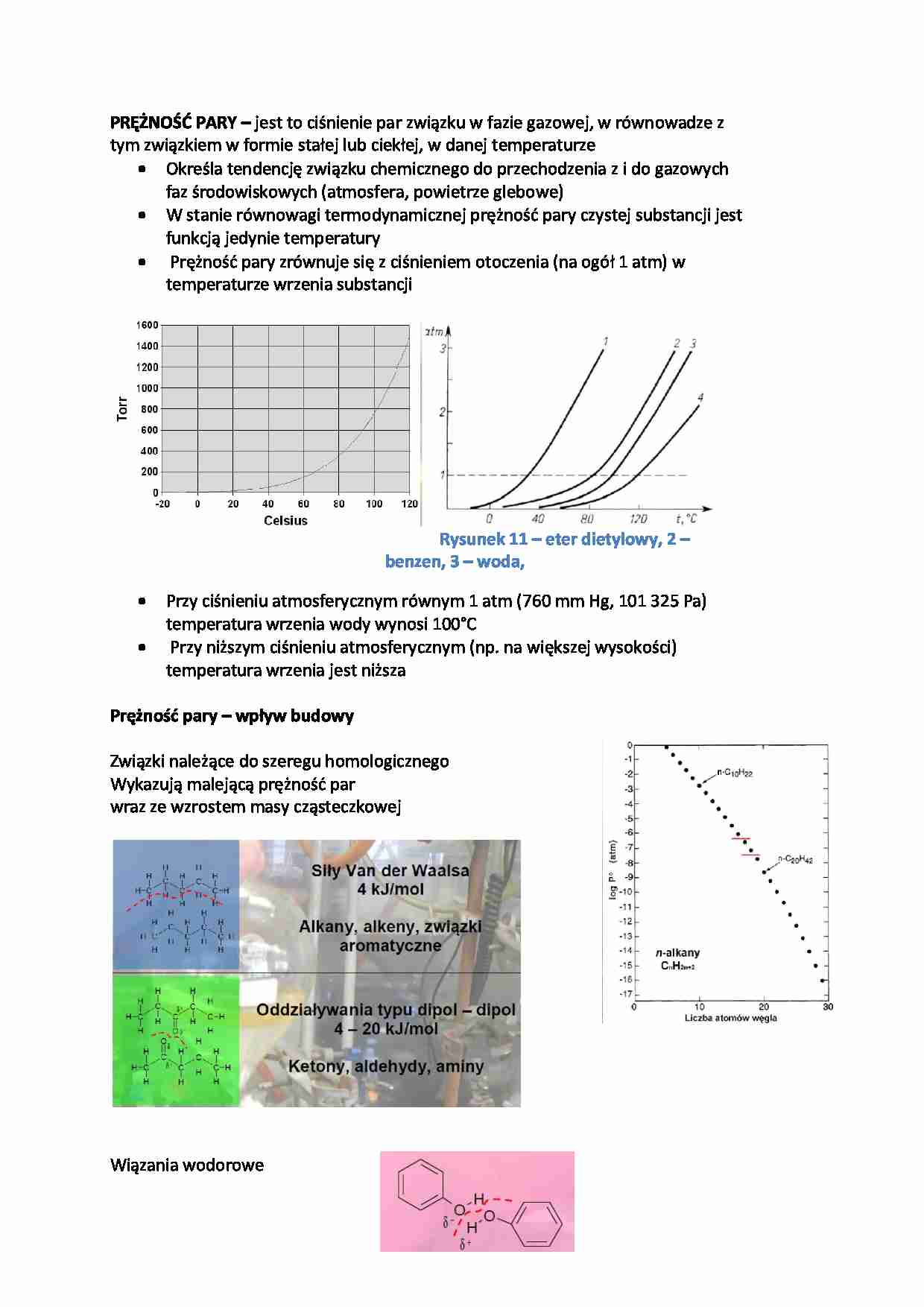


PRĘŻNOŚĆ PARY – jest to ciśnienie par związku w fazie gazowej, w równowadze z tym związkiem w formie stałej lub ciekłej, w danej temperaturze Określa tendencję związku chemicznego do przechodzenia z i do gazowych faz środowiskowych (atmosfera, powietrze glebowe) W stanie równowagi termodynamicznej prężność pary czystej substancji jest funkcją jedynie temperatury Prężność pary zrównuje się z ciśnieniem otoczenia (na ogół 1 atm) w temperaturze wrzenia substancji Rysunek 11 – eter dietylowy, 2 – benzen, 3 – woda, Przy ciśnieniu atmosferycznym równym 1 atm (760 mm Hg, 101 325 Pa) temperatura wrzenia wody wynosi 100°C Przy niższym ciśnieniu atmosferycznym (np. na większej wysokości) temperatura wrzenia jest niższa Prężność pary – wpływ budowy Związki należące do szeregu homologicznego Wykazują malejącą prężność par wraz ze wzrostem masy cząsteczkowej Wiązania wodorowe 4 – 20 kJ/mol Alkohole, fenole, aminy Oddziaływania typu π – π 4 – 40 kJ/mol Związki aromatyczne Wiązania jonowe 20 – 40 kJ/mol Rożne Prężność pary – zanieczyszczenia Prężność par popularnych zanieczyszczeń waha się w szerokich granicach Proste chlorowane rozpuszczalniki są bardzo lotne (BP rzędu 40 - 77°C; VP rzędu 15 300 - 58 000 Pa) Związki o większej masie (np. WWA, PCB) mają znacznie mniejsze wartości prężności pary Stała Henry'ego (KH) Stała podziału substancji pomiędzy roztworem wodnym (ktory może być roztworem więcej niż jednej substancji) a powietrzem w stanie rownowagi termodynamicznej W powietrzu (fazie gazowej) obecność substancji wyraża się ciśnieniem cząstkowym Pi (atm) W roztworze wodnym obecność substancji wyraża się stężeniem molowym CW (mol/L) Jeżeli wyrazimy Pi jako liczbę moli w objętości to stała będzie bezwymiarowa – KH’ Ca zależne będzie od warunków otoczenia stąd: KH jest funkcją zarowno lotności jak i rozpuszczalności
... zobacz całą notatkę






Komentarze użytkowników (0)