To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
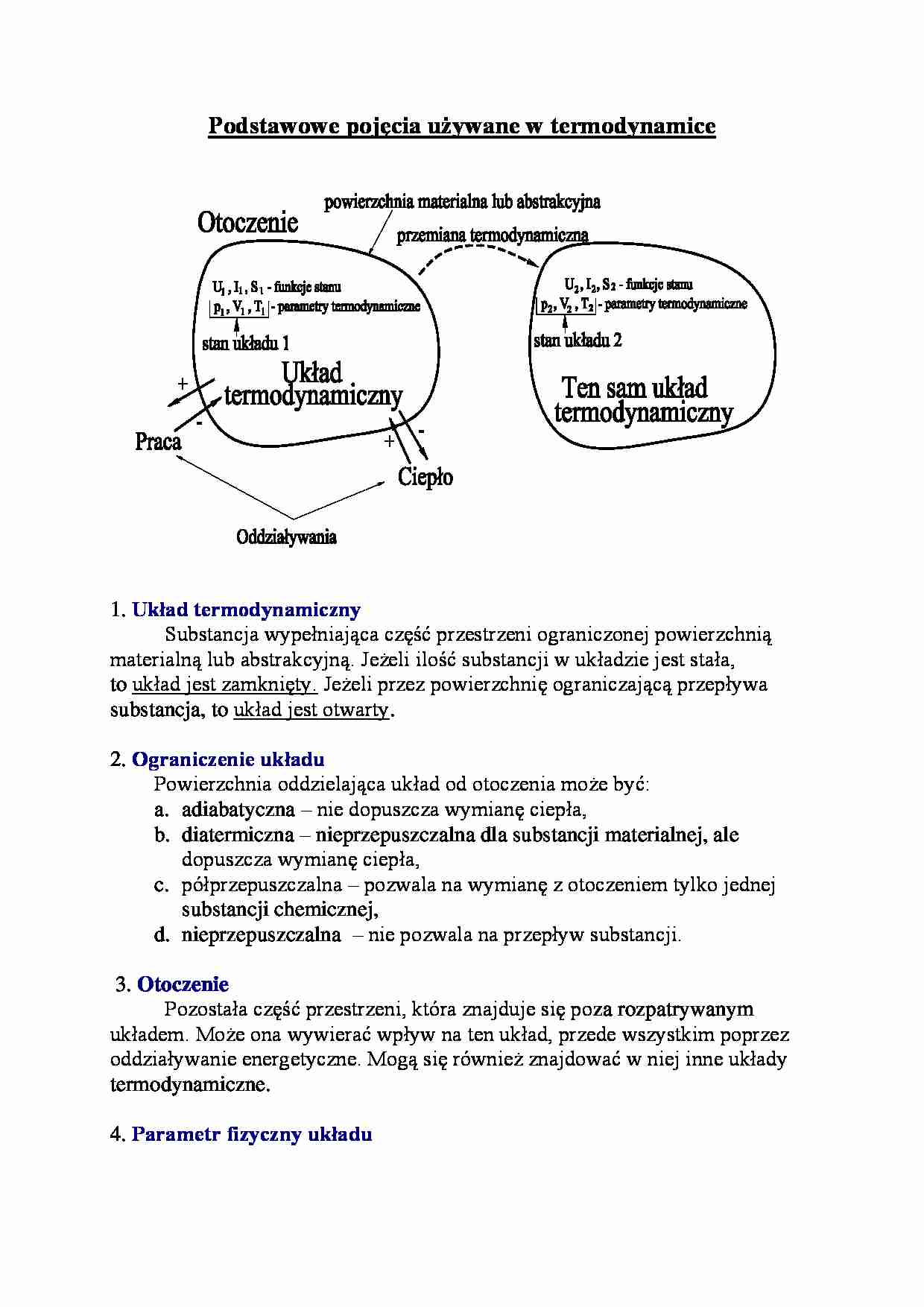


Podstawowe pojęcia używane w termodynamice
1. Układ termodynamiczny
Substancja wypełniająca część przestrzeni ograniczonej powierzchnią materialną lub abstrakcyjną. Jeżeli ilość substancji w układzie jest stała,
to układ jest zamknięty. Jeżeli przez powierzchnię ograniczającą przepływa
substancja, to układ jest otwarty. 2. Ograniczenie układu
Powierzchnia oddzielająca układ od otoczenia może być:
adiabatyczna - nie dopuszcza wymianę ciepła,
diatermiczna - nieprzepuszczalna dla substancji materialnej, ale dopuszcza wymianę ciepła,
półprzepuszczalna - pozwala na wymianę z otoczeniem tylko jednej substancji chemicznej,
nieprzepuszczalna - nie pozwala na przepływ substancji.
3. Otoczenie
Pozostała część przestrzeni, która znajduje się poza rozpatrywanym układem. Może ona wywierać wpływ na ten układ, przede wszystkim poprzez oddziaływanie energetyczne. Mogą się również znajdować w niej inne układy
termodynamiczne.
4. Parametr fizyczny układu
Obserwowalna wielkość charakterystyczna dla danego układu, której znajomość nie wymaga znajomości historii układu. Jego wartość nie zależy od przemian, jakim podlega układ.
5. Parametr termodynamiczny układu
Parametr fizyczny, którego zmiana jest istotna z punktu widzenia badanego zjawiska termodynamicznego. Jeżeli wartość parametru nie zależy od ilości substancji, to taki parametr nazywamy intensywnym np. temperatura t lub
ciśnienie p. W przeciwnym razie parametr nazywamy ekstensywnym np. energia lub objętość układu.
6. Stan układu
Określony poprzez wartości wszystkich parametrów termodynamicznych.
Dwa stany są identyczne, jeżeli wartości wszystkich parametrów opisujących dany układ w obu stanach są jednakowe.
7. Równowaga termodynamiczna
Stan, który ustala się samorzutnie w układzie odizolowanym od oddziaływań zewnętrznych i pozostaje niezmienny w czasie, gdy parametry stanu tego układu nie ulegają zmianie w czasie. Dla zachowania równowagi termodynamicznej układu musi być zachowana jego: równowaga mechaniczna (równowaga sił i momentów), chemiczna (skład chemiczny jest stały) i termiczna (brak wymiany ciepła z otoczeniem i temperatura w każdym punkcie jest taka sama).
a) układ jest w równowadze trwałej, jeżeli skończona zmiana jego stanu powoduje również skończoną zmianę w stanie otoczenia,
b) układ jest w równowadze obojętnej, jeżeli skończona zmiana jego stanu
jest możliwa bez odpowiedniej zmiany stanu otoczenia, przy czym stan
(…)
… rzeczywiste.
Równanie stanu gazu doskonałego (Clapeyrona)
Iloczyn ciśnienia bezwzględnego i objętości gazu podzielonego przez temperaturę bezwzględną jest równy stałej gazowej R [J/kg K], której wartość dla każdego gazu jest inna. = MR = const (6)
…
… założenia co do ich budowy a tym samym własności rozróżniamy trzy rodzaje gazów:
Gaz doskonały - posiada stałe ciepło właściwe (niezależne od temperatury i ciśnienia), nie zmienia stanu skupienia (nie ulega skropleniu) i można go traktować jako zbiór cząstek stanowiących punkty materialne. Ściśle podporządkowuje się prawom gazowym. Gaz półdoskonały - taki sam jak gaz doskonały z tą tylko różnicą…
... zobacz całą notatkę






Komentarze użytkowników (0)