To tylko jedna z 5 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


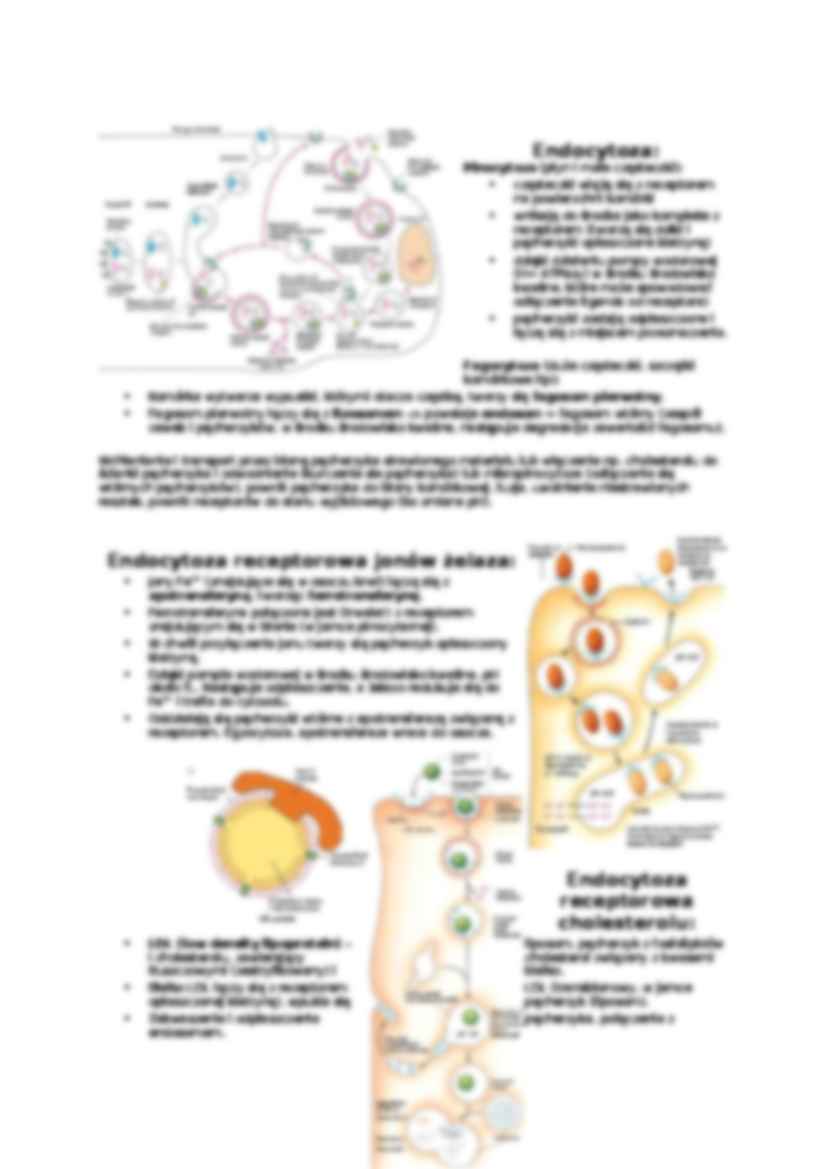
Przyczyny niszczenia białek:
Białka nieudane, np. źle sfałdowane, podlegają poliubikwitynacji - do określonych aminokwasów (lizyn) dołączana jest ubikwityna, która "kieruje" białko do proteasomów.
"Nieudane" białko: jest niewłaściwie sfałdowane ma zgrupowanie lizyn "na wierzchu" pierwszym aminokwasem jest metionina, seryna, treonina, alanina, walina, cysteina, glicyna. Proteosomy to cylindry z proteaz rozkładających białka. Zamykany jest kompleksem białkowym ("wieczkiem"). Białka przeznaczone do degradacji wciągane są do wnętrza cylindra (ale muszą mieć "sygnał" w postaci ubikwityny!). Białka błonowe i pozostające wewnątrz pęcherzyków:
Nie wszystkie białka mogą swobodnie pływać sobie z cytoplazmie. Niektóre (np. enzymy proteolityczne) muszą zajmować określone kompartmenty i być oddzielone od reszty komórki, gdyż np. moga trawić potrzebne cząsteczki. Do umieszczania białek w we wnętrzu błony / pęcherzyka lub zakotwiczania ich w błonie służy tzw. kotranslacja. Białka błonowe syntetyzowane są przez rybosomy przyczepione do szorstkiej siateczki endoplazmatycznej. Translacja rozpoczyna się, gdy połączą się obie podjadnostki rybosomu oraz mRNA. Zwykle pierwsza powstaje sekwencja sygnałowa o długości 21 aminokwasów. Do niej dołącza się peptyd sygnałowy SRP (cząsteczka rozpoznająca sekwencję; po przyłączeniu hamuje translację). Potrzebne jest też 7s RNA.
(…)
… odcinana jest sekwencja sygnałowa). Translokacja zostaje rozpoczęta ponownie przez sekwencję start-transfer itp. Po odcięciu peptydu sygnałowego białko pozostaje w błonie.
Rola aparatu Golgiego:
Aparat Golgiego jest systemem cystern i pęcherzyków. Jego główną rolą jest "segregacja" białek i ich modyfikacja (dodawanie grup węglowodanowych do przyszłych glikoprotein). Od strony siateczki endoplazmatycznej…
... zobacz całą notatkę






Komentarze użytkowników (0)