Chemia j drowa
Atom i jego składniki
Materia wyst puje jako masa i energia.
Pomi dzy nimi zachodzi cisła współzale no , któr ilo ciowo
ujmuje wzór Einsteina, zwany prawem równowa no ci masy i
energii
E = mc2
E - energia, m - masa, c- pr dko
wiatła w pró ni ~ 3·1010 cm/s
Materia, zbudowana jest z małych cz steczek, zwanych atomami.
Obecnie ju wiadomo, e atom wcale nie jest najmniejsz cz stk
materii, gdy
wykryto cz stki jeszcze mniejsze od niego, np.
elektron, proton, neutron
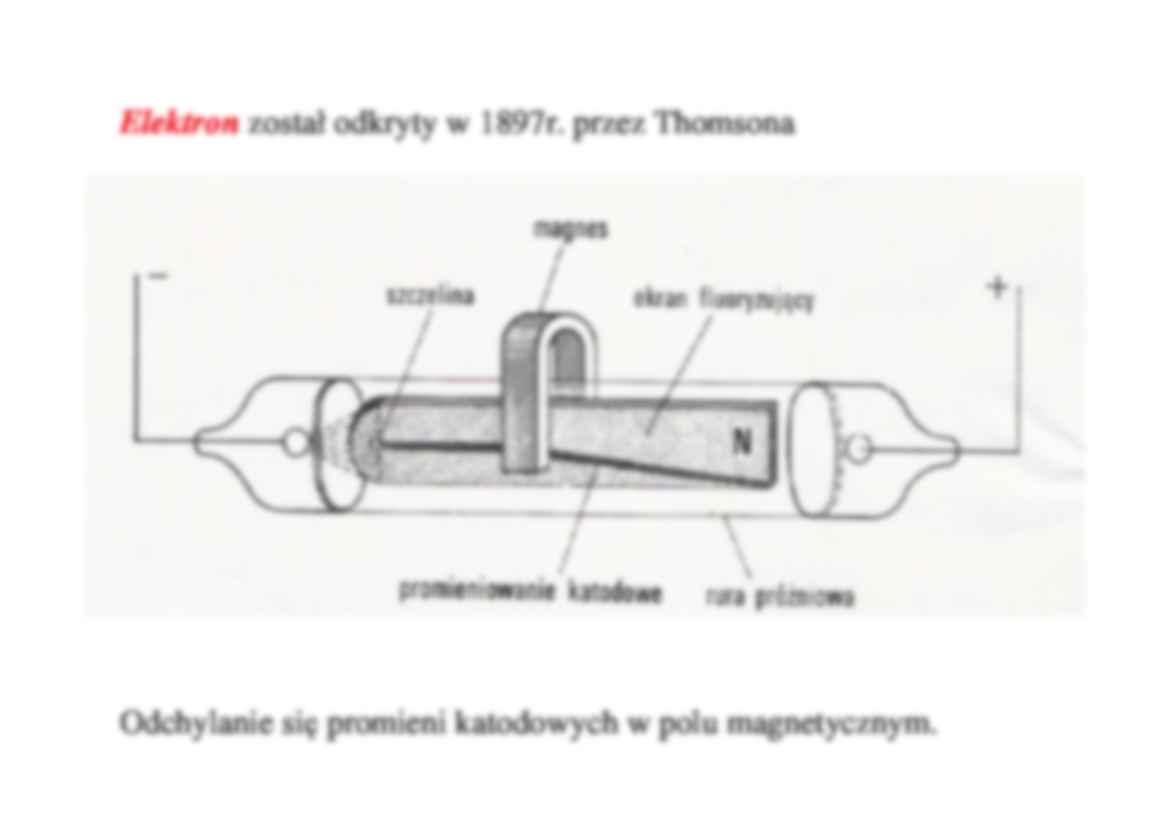
Elektron został odkryty w 1897r. przez Thomsona
Odchylanie si promieni katodowych w polu magnetycznym.
Budowa j dra atomowego
Po odkryciu przez Rutherforda j dra atomowego dalsze
badania wykazały, e w skład jego jeszcze wchodz mniejsze
cz stki, nazwane protonami.
Protony,
podobnie
jak
elektrony,
s
cz stkami
elementarnymi atomu. Proton, w odró nieniu do elektronu ma
jednak ładunek dodatni.
W 1932r. Chadwick wykrył w j drze now
elementarn
cz stk
o masie zbli onej do masy protonu, lecz nie
maj cej ładunku, któr nazwano neutronem.
Z powy szego wynika, e j dra atomowe składaj si z
protonów i neutronów.
Oba te rodzaje cz stek nazwano nukleonami.
Nazwa
Symbol
Masa
Ładunek
Proton
Neutron
Elektron
p
n
e-
1,008
1,009
0,0006
+1
0
-1
A
Z
X
A – liczba masowa, liczba całkowita równa liczbie nukleonów
(sumarycznej liczbie protonów i neutronów) w j drze atomowym.
Z – liczba atomowa, liczba całkowita charakteryzuj ca dany
pierwiastek, równa liczbie protonów w j drze atomowym. Jest tak e
zwana liczba porz dkow .
Budowa atomu i cz steczki chemicznej
Model atomu Bohra
W 1913r Bohr zaproponował dokładniejszy model budowy atomu
ani eli Rutherford.
Postulaty Bohra:
Elektron mo e kr y dookoła j dra tylko po orbitach o ci le
okre lonym promieniu r, przy czym spełnione jest
równanie;
2 m r = nh
m r – moment p du elektronu na orbicie;
m - masa elektronu,
- pr dko
elektronu, r - promie
orbity,
n – całkowita liczba naturalna (1,2,3...),
h – stała Plancka (6,626·10-34J·s) zwana równie kwantem
działania.
Podczas przechodzenia elektronu z jednej orbity na drug ,
jest emitowana lub pochłaniania okre lona energia:
E = E2 - El = h
El – energia elektronu na orbicie 1,
E2 – energia elektronu na orbicie 2,
E - energia emitowana lub pochłaniania przez atom,
- stała Plancka (kwant działania),
– cz sto
emitowanego lub pochłanianego promieniowania
h
Orbity
elektronowe
atomu
nazywa
si
powłokami
elektronowymi.
Powłoki oznacza si literami: K, L, M, N, O, P, Q lub liczbami
1, 2, 3,..., poczynaj c od powłoki le cej najbli ej j dra.
Jonizacja elektron zostaje całkowicie wyrzucony na zewn trz,
atom staje si dodatnio naładowanym jonem.
... zobacz całą notatkę





Komentarze użytkowników (0)