To tylko jedna z 12 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


LABORATORIUM METOD POMIAROWYCH I ZAST. KOMPUTERÓW
Materiały pomocnicze do wykonania ćwiczenia: "Badania procesów chemicznego i elektrochemicznego osadzania metali”
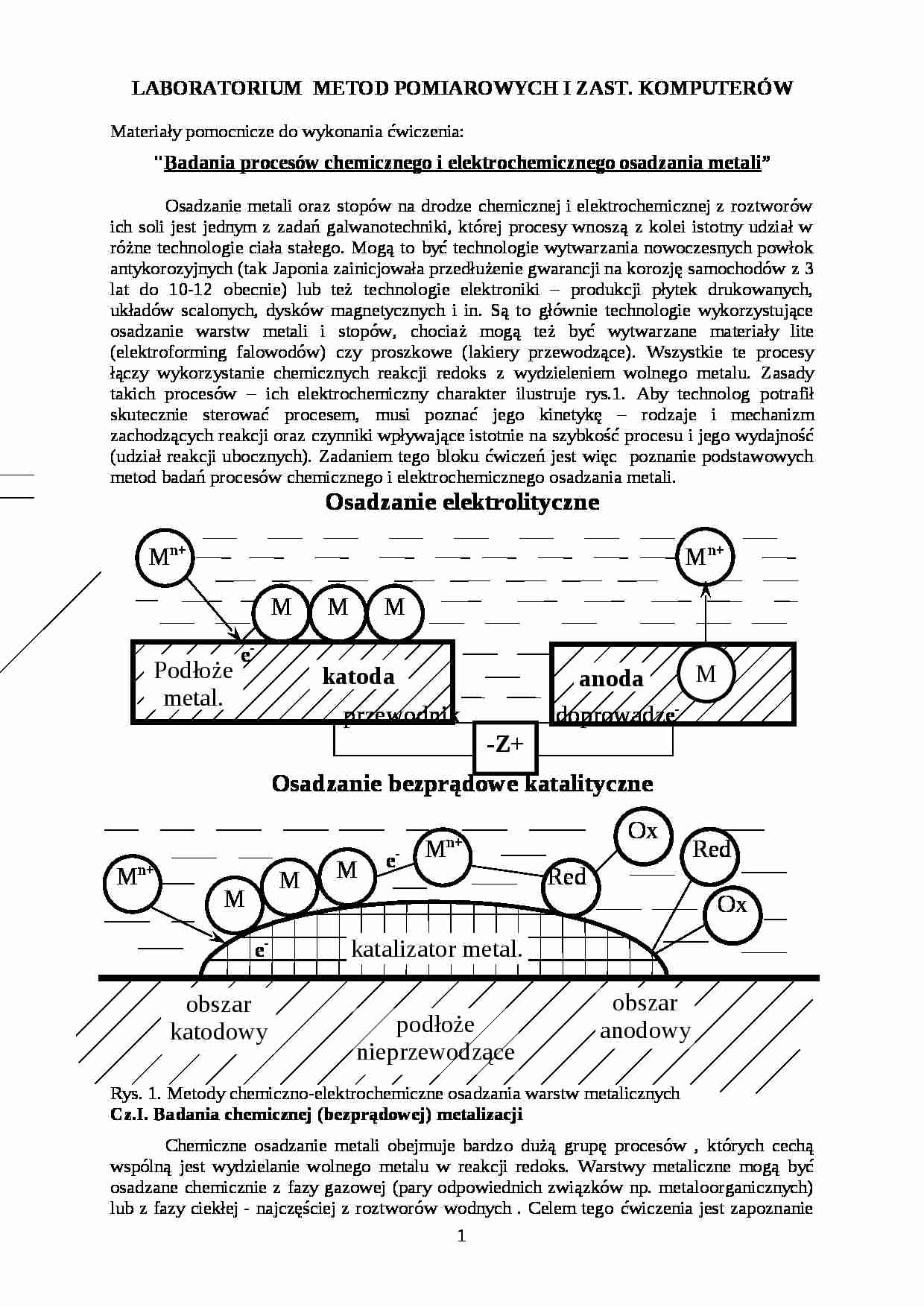
Osadzanie metali oraz stopów na drodze chemicznej i elektrochemicznej z roztworów ich soli jest jednym z zadań galwanotechniki, której procesy wnoszą z kolei istotny udział w różne technologie ciała stałego. Mogą to być technologie wytwarzania nowoczesnych powłok antykorozyjnych (tak Japonia zainicjowała przedłużenie gwarancji na korozję samochodów z 3 lat do 10-12 obecnie) lub też technologie elektroniki - produkcji płytek drukowanych, układów scalonych, dysków magnetycznych i in. Są to głównie technologie wykorzystujące osadzanie warstw metali i stopów, chociaż mogą też być wytwarzane materiały lite (elektroforming falowodów) czy proszkowe (lakiery przewodzące). Wszystkie te procesy łączy wykorzystanie chemicznych reakcji redoks z wydzieleniem wolnego metalu. Zasady takich procesów - ich elektrochemiczny charakter ilustruje rys.1. Aby technolog potrafił skutecznie sterować procesem, musi poznać jego kinetykę - rodzaje i mechanizm zachodzących reakcji oraz czynniki wpływające istotnie na szybkość procesu i jego wydajność (udział reakcji ubocznych). Zadaniem tego bloku ćwiczeń jest więc poznanie podstawowych metod badań procesów chemicznego i elektrochemicznego osadzania metali. Osadzanie elektrolityczne
Mn+ Mn+ przewodnik doprowadz. Osadzanie bezprądowe katalityczne
Mn+ Red Mn+ Red
Ox Rys. 1. Metody chemiczno-elektrochemiczne osadzania warstw metalicznych Cz.I. Badania chemicznej (bezprądowej) metalizacji Chemiczne osadzanie metali obejmuje bardzo dużą grupę procesów , których cechą wspólną jest wydzielanie wolnego metalu w reakcji redoks. Warstwy metaliczne mogą być osadzane chemicznie z fazy gazowej (pary odpowiednich związków np. metaloorganicznych) lub z fazy ciekłej - najczęściej z roztworów wodnych . Celem tego ćwiczenia jest zapoznanie się z problemami chemicznego osadzania metali na przykładzie procesu chemicznej metalizacji z roztworów wodnych. Są trzy główne przyczyny stosowania tego procesu:
(…)
… uzyskuje się dla roztworów alkalicznych.
Dla większości wydzielanych metali konieczne jest kompleksowanie w środowisku alkalicznym, aby nie dopuścić do wytrącania się wodorotlenków i soli zasadowych. W praktyce stosuje się organiczne związki kompleksujące typu hydroksykwasów (kwas cytrynowy), aminokwasów (glicyna, EDTA) i inne związki chelatujące. Związki te z reguły mają równocześnie dobre własności…
… - elektroda pomocnicza np. spirala Pt.
Potencjostaty pozwalają zwykle na ustalenie potencjału elektrody badanej w granicach *3000nV względem elektrody odniesienia przy czym helipot (potencjometr obrotowy) posiada 10x100 działek pomiarowych - nastawczych, tzn. 1dz = 3 mV. Galwanostaty (prądostaty) posiadają różne zakresy prądowe np. *100mA, *2000mA itp.
Dobór rejestratora zależy od rodzaju układu i badanego…
… nie jest dostateczny do rozładowania, tj. przyjęcia elektronów przez jony. Dopiero zwiększenie spadku napięcia w warstwie podwójnej prowadzi do rozpoczęcia procesu elektrolizy a w szczególności do wydzielania metalu na katodzie. Nie jest możliwe wyliczenie lub bezpośrednie zmierzenie spadku napięcia na granicy metal-roztwór. Dlatego też w elektrochemii stosuje się pojęcie "potencjał elektrody", definiowane jako spadek napięcia (SEM) między daną elektrodą badaną a wzorcową elektrodą odniesienia. Potencjał elektrody oznacza się obecnie najczęściej symbolem “E” (z różnymi deskryptorami) Uniwersalną elektrodą odniesienia jest elektroda wodorowa, której umowny potencjał przyjęto za równy 0. Znacznie wygodniejsza w użyciu jest tzw. nasycona elektroda kalomelowa (NEK) o potencjale około +0.25V/EH. Pomiar spadku…
... zobacz całą notatkę






Komentarze użytkowników (0)