To tylko jedna z 5 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
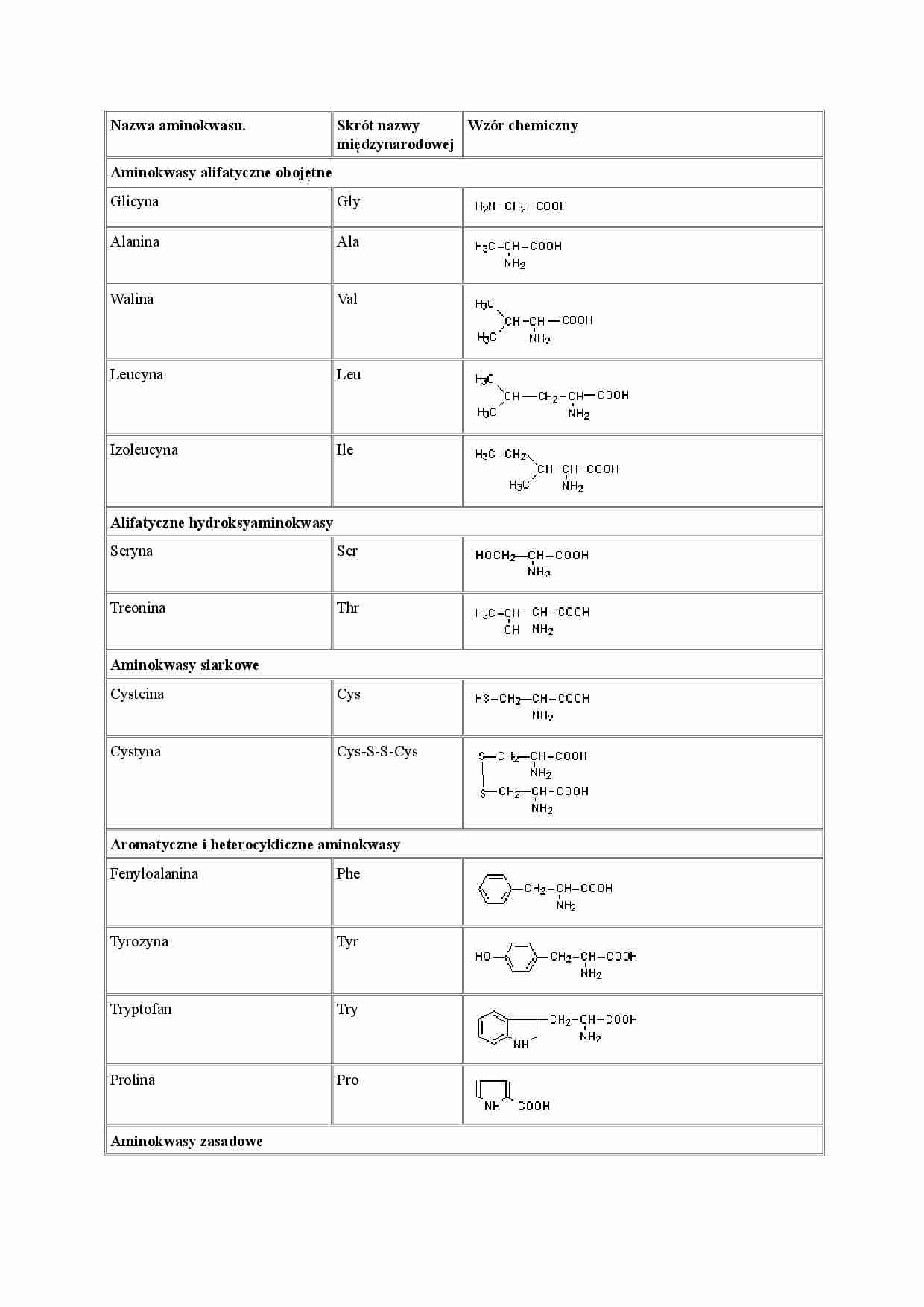


Nazwa aminokwasu. Skrót nazwy międzynarodowej Wzór chemiczny Aminokwasy alifatyczne obojętne Glicyna Gly Alanina Ala Walina Val Leucyna Leu Izoleucyna Ile Alifatyczne hydroksyaminokwasy Seryna Ser Treonina Thr Aminokwasy siarkowe Cysteina Cys Cystyna Cys-S-S-Cys Aromatyczne i heterocykliczne aminokwasy Fenyloalanina Phe Tyrozyna Tyr Tryptofan Try Prolina Pro Aminokwasy zasadowe Lizyna Lys Arginina Arg Histydyna His Aminokwasy kwaśne i ich amidy Kwas asparaginowy Asp Asparagina Asn lub Asp-NH2 Kwas glutaminowy Glu glutamina Gln lub Glu-NH2 Stała Michaelisa ( K m) – jest to takie stężenie substratu, przy którym szybkość reakcji enzymatycznej j est równa połowie szybkości maksymalnej (Vmax) tej reakcji. Stała ta jest wyrażana w molach na dm³ i określa powinowactwo enzymu do substratu: im jest mniejsza, tym powinowactwo jest większe, natomiast duża wartość tej stałej mówi o małym powinowactwie enzymu do substratu. Wartość stałej Km dla większości enzymów przyjmuje wartości z zakresu 10-3 do 10-5 mol/dm3 Równanie Michaelisa-Menten opi suje zależność szybkości reakcji od stężenia substratu: Postać Km = [S] jest matematycznym zapisem definicji stałej Michaelisa. Analizując równanie Michaelisa- Menten można dojść do wniosku, iż przy stałym stężeniu enzymu, szybkość reakcji w pewnych granicach zależy od stężenia substratu, na wykresie zależności szybkości reakcji od stężenia substratu widać że: • przy niewielkim stężeniu substratu w stosunku do stężenia enzymu, pojawia się zależność liniowa, między stężeniem substratu a szybkością reakcji, ta sytuacja odpowiada reakcji kinetycznej pierwszego rzędu opisywanej równaniem v = k [ A ] • w przypadku dużego stężenia substratu, szybkość reakcji zbliża się do jej maksymalnej wartości i stężenie substratu nie ma wpływu na szybkość reakcji, sytuacja ta odpowiada kinetyce zerowego rzędu opisywanej równaniem v = k . Tego typu reakcja ma miejsce w przypadku całkowitego wysycenia enzymu substratem. Co wpływa na stałą Michaelisa: • rodzaj i stężenie substratu • pH • temperatura • siła jonowa Stała Km nie zależy od stężenia enzymu! Co wynika ze stałej Michaelisa : Ponieważ mówi ona przy jakim stężeniu szybkość reakcji osiąga wartość maksymalną, jej wartość jest pomocna w przypadkach oznaczania i badania enzymów. Krzywa zawartości enzymu w roztworze przedstawiająca związek pomiędzy stężeniem substratu i szybkości reakcji. Typy inhibicji [ Inhibicja kompetycyjna W inhibicji kompetycyjnej inhibitor i substrat współzawodniczą o miejsce aktywne cząsteczki
(…)
… dla określonego
enzymu. Na przykład metotreksat jest inhibitorem kompetycyjnym dla enzymu reduktazy
dihydrofolianu, który katalizuje redukcję dihydrofolianu do tetrahydrofolianu i obie
substancje są strukturalnie bardzo zbliżone. Przyłączenie inhibitora uniemożliwia związanie
substratu i odwrotnie, dzięki czemu poprzez regulację stężenia inhibitora możliwa jest
kontrola szybkości reakcji. Stałą dysocjacji inhibitora kompetycyjnego można opisać
równaniem[52][58]:
W inhibicji kompetycyjnej maksymalna szybkość reakcji (Vmax) nie zmienia się i może być
osiągnięta poprzez zwiększenie stężenia substratów, które przezwycięży inhibicję. Zmianie
natomiast ulega pozorna wartość Km, nowa wartość Km, zwana Kmapp (pozorna stała
Michaelisa) jest równa[58]:
gdzie: [I] – stężenie inhibitora, Ki – stała dysocjacji…
… i inhibitora o miejsce aktywne, możliwa jest
kontrola prędkości zachodzącej reakcji. W inhibicji niekompetycyjnej inhibitor nie konkuruje
z substratem o miejsce aktywne lecz wiąże się w innym miejscu, doprowadzając do powstania
nieaktywnego kompleksu
Elastaza, (EC 3.4.21.37), to enzym należący do grupy hydrolaz, a dokładniej - endopeptydaz.
W swoim centrum aktywnym zawiera aminokwas serynę…
... zobacz całą notatkę






Komentarze użytkowników (0)