Sylwia Krupa 10.04.2013
Kalina Ziewiec
Joanna Owczarek
Wyznaczanie prężności pary ciekłego propan-1-olu
Cel
Celem ćwiczenia jest wyznaczenie entalpii i entropii parowania propan-1-olu i sprawdzenie czy spełnia on regułę Troutona.
Opracowanie wyników
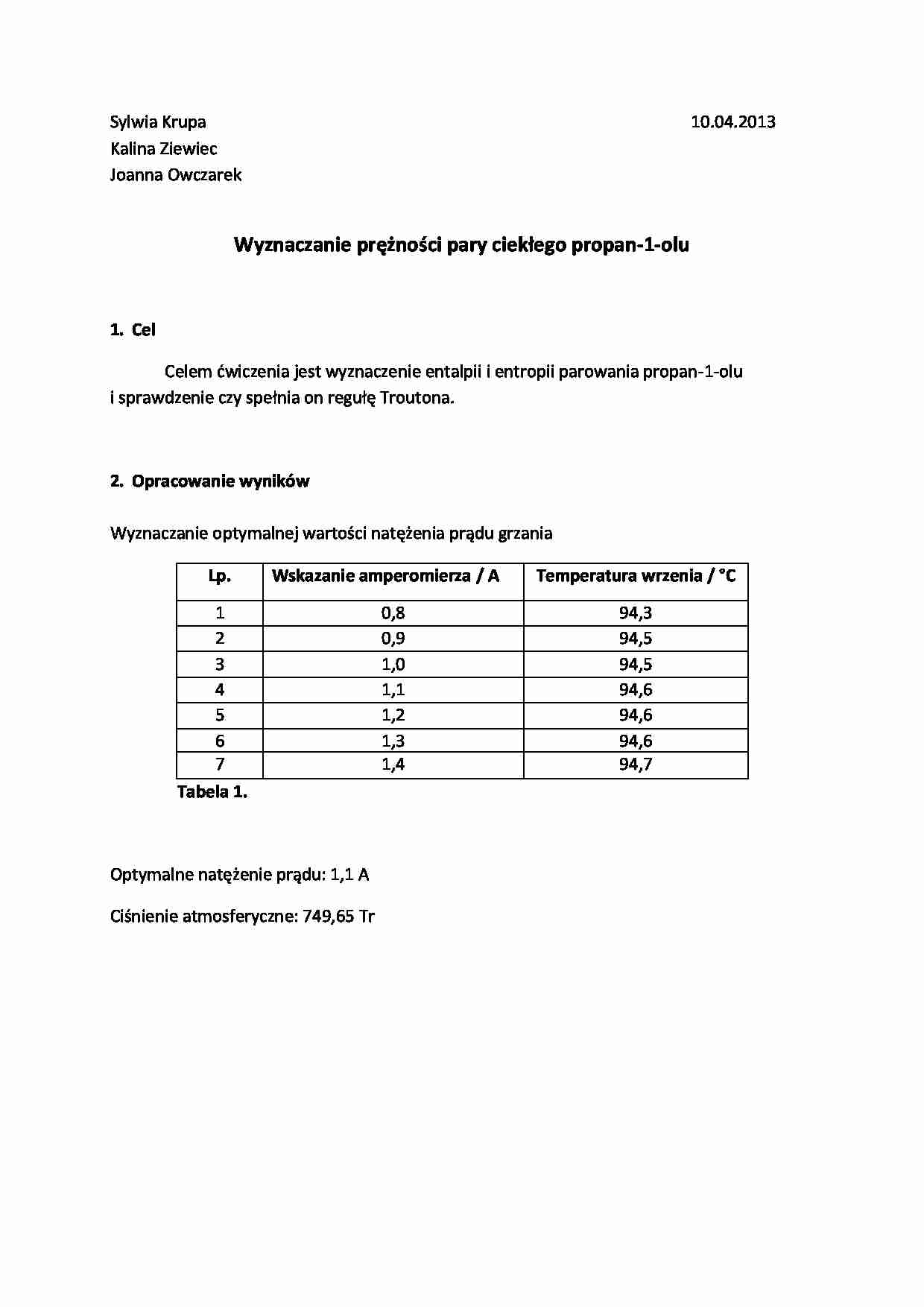
Wyznaczanie optymalnej wartości natężenia prądu grzania
Lp.
Wskazanie amperomierza / A
Temperatura wrzenia / °C
1
0,8
94,3
2
0,9
94,5
3
1,0
94,5
4
1,1
94,6
5
1,2
94,6
6
1,3
94,6
7
1,4
94,7
Tabela 1. Optymalne natężenie prądu: 1,1 A
Ciśnienie atmosferyczne: 749,65 Tr
lp.
lnp
/ Tr
T / K
T-1 / K-1 ·10-3
Różnica ciśnień
/ Tr
1
6,620
367,6
2,7203
0
2
6,536
365,3
2,7375
60
3
6,484
364,3
2,7450
95
4
6,441
363,1
2,7541
122,5
5
6,392
361,9
2,7632
152,5
6
6,341
360,6
2,7732
182,5
7
6,291
359,4
2,7824
210,0
8
6,247
358,2
2,7917
233,0
9
6,188
357,1
2,8003
263,0
10
6,136
355,7
2,8114
287,5
11
6,070
354,3
2,8225
317,0
12
6,010
353,0
2,8329
342,0
13
5,978
352,1
2,8401
355,0
14
5,946
351,3
2,8466
367,5
Tabela 2. Wyniki pomiarów.
Wykres. Zależność logarytmu naturalnego z ciśnienia w funkcji odwrotności temperatury wrzenia propan-1-olu.
(…)
…
263,0
10
6,136
355,7
2,8114
287,5
11
6,070
354,3
2,8225
317,0
12
6,010
353,0
2,8329
342,0
13
5,978
352,1
2,8401
355,0
14
5,946
351,3
2,8466
367,5
Tabela 2. Wyniki pomiarów.
Wykres. Zależność logarytmu naturalnego z ciśnienia w funkcji odwrotności temperatury wrzenia propan-1-olu.
Korzystając z równania Clausiusa - Clapeyrona i funkcji REGLINP w programie Microsoft Excel wyznaczono równanie prostej lnp = f(1/T).
Sprowadzamy powyższe równanie do postaci y = ax + b , gdzie :
y = lnp
x = b = const a = Dla dziewięciu stopni swobody oraz na poziomie α = 0,05 odczytujemy z tablic t- studenta
wartość tα:
tα = 2,262
Wyliczone współczynniki a i b równania liniowego:
a = - 5386,00 ∆a = 31,64
b = 21,27 ∆b = 0,09
Równanie prostej ma zatem postać:
lnp = -5386·( + 21,27
Z otrzymanego równania wyznaczono entalpię parowania:
Wyznaczono normalną temperaturę wrzenia pod ciśnieniem atmosferycznym z równania:
Tw = = 367,64 K
Wyznaczono entropię parowania i porównano ją z regułą Troutona:
∆Sw = 12 3. Błędy:
wyznaczania entalpii parowania:
Niepewność ∆H obliczono mnożąc odchylenie standardowe S∆H przez wartość rozkładu t-Studenta na poziomie ufności α = 0,05 i n-2 stopniach swobody (t0,05;n-2 =2,179), zatem:
a = - 5,39…
… w wyniku obecności wiązań wodorowych. …
... zobacz całą notatkę


Komentarze użytkowników (0)