Z jej treści dowiemy się więcej o tym, jakie są właściwości fizyczne i chemiczne pierwiastków takich, jak: wodór, chlor, brom, jod, tlen, siarka, azot, fosfor, amoniak i węgiel.
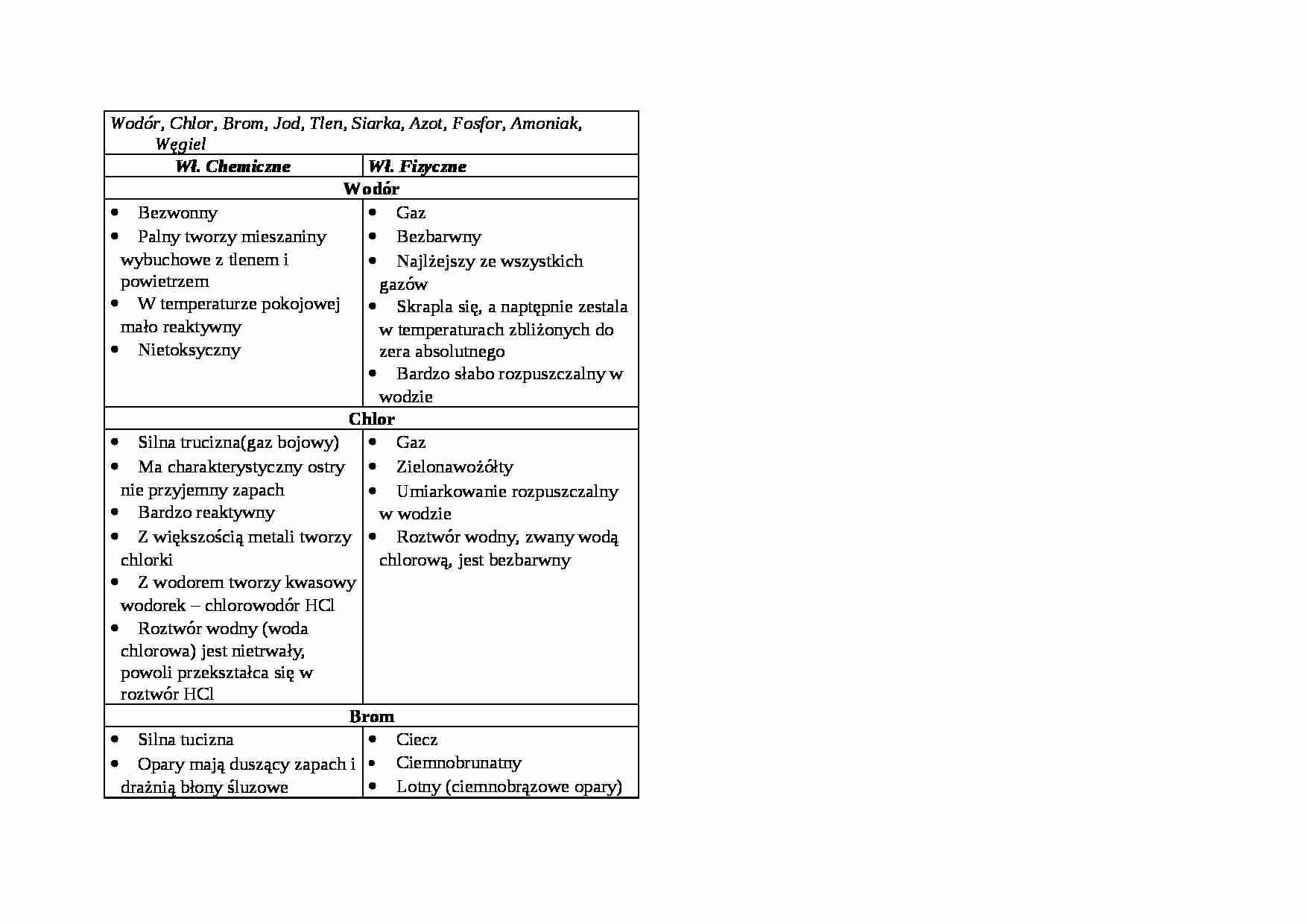
Wodór, Chlor, Brom, Jod, Tlen, Siarka, Azot, Fosfor, Amoniak, Węgiel
Wł. Chemiczne
Wł. Fizyczne
Wodór
Bezwonny
Palny tworzy mieszaniny wybuchowe z tlenem i powietrzem W temperaturze pokojowej mało reaktywny
Nietoksyczny
Gaz
Bezbarwny
Najlżejszy ze wszystkich gazów
Skrapla się, a naptępnie zestala w temperaturach zbliżonych do zera absolutnego
Bardzo słabo rozpuszczalny w wodzie
Chlor
Silna trucizna(gaz bojowy)
Ma charakterystyczny ostry nie przyjemny zapach
Bardzo reaktywny
Z większością metali tworzy chlorki
Z wodorem tworzy kwasowy wodorek - chlorowodór HCl
Roztwór wodny (woda chlorowa) jest nietrwały, powoli przekształca się w roztwór HCl
Gaz
Zielonawożółty
Umiarkowanie rozpuszczalny w wodzie
Roztwór wodny, zwany wodą chlorową, jest bezbarwny
Brom
Silna tucizna
Opary mają duszący zapach i drażnią błony śluzowe
Parzy skórę i wywołuje trudno gojące się rany
Reaktywny Z większością metali tworzy bromki
Roztwór wodny (woda bromowa) jest nietrwały, w ciągu kilkunastu dni przekształca się w HBr
Ciecz
Ciemnobrunatny
Lotny (ciemnobrązowe opary)
Umiarkowanie rozpuszczalny w wodzie
Roztwór wodny, woda bromowa, jest brązowy
Dobrze rozpuszczalny w rozpuszczalnikach organicznych
Jod
Trujący
Opary jodu, o charakterystycznym zapachu, drażnią błony śluzowe, zwłaszcza oczu
Z większością metali tworzy jodki
Roztwarza się w wodnym roztworze jodku potasu, tworząc jony I-3 (trijodkowe): I2 + I- → I-3
Ze skrobią tworzy związek o charakterystycznym fioletowo niebieskim zabarwieniu
Ciało stałe
Tworzy fioletowo czarne łuski o metalicznym połysku
Łatwo sublimuje, opary są fioletowo czerwone
Praktycznie nierozpuszczalny w wodzie
Rozpuszczalny w rozpuszczalnikach organicznych
Roztwór jodu w alkoholu etylowym nazywany jest jodyną
Tlen
Bezwonny
Reaktywny
Łączy się z większością pierwiastków dając tlenki
Jako substrat procesów utleniania, w tym oddychania, jest niezbędny do funkcjonowania organizmów żywych
Gaz
Bezbarwny
Skrapla się, a następnie zestala w temperaturach zbliżonych do -200oC Słabo rozpuszczalny w wodzie, ale w ilościach wystarczających dla organizmów żyjących w wodach powierzchniowych
Siarka
Ma słaby, ale charakterystyczny zapach
Reaktywna Palna
Reaguje z wieloma metalami dają siarczki
Typowy niemetal
Ciało stałe
Żółta, o tłustym połysku
Kruch
Cięższa od wody
Praktycznie nie rozpuszczalna w wodzie
Azot
Bezwonny Mało reaktywny
(…)
… w wodzie (słabiej niż tlen)
Fosfor
Odmiana biała jest silną trucizną, czerwona nie
Fosfor biały jest łatwo palny i należy go przechowywać, a nawet kroić pod wodą; fosfor czerwony zapala się dopiero w temperaturze 400oC
Tworzy związki z wieloma metalami (fosforki) i niemetalami
Typowy niemetal
Ciało stałe
Tworzy kilka odmian alotropowych, z których dwie: fosfor biały (woskowa masa) i fosfor czerwony (proszek) są najłatwiej dostępne
Praktycznie nie rozpuszczalny w wodzie
Fosfor biały świeci w ciemnościach
Amoniak
Trujący Palny (tworzy mieszaninę wybuchową z tlenem)
Ma charakterystyczny, ostry zapach, drażniący błony śluzowe
Wodne roztwory mają odczyn zasadowy
Reaguje z kwasami, dając sole aminowe
Gaz
Bezbarwny
Lżejszy od powietrza
Bardzo dobrze rozpuszczalny w wodzie
Jeden z produktów handlowych, zwany stężonym amoniakiem lub wodą amoniakalną, jest 25-procentowym (jeśli nie zaznaczono inaczej na etykiecie) wodnym roztworem amoniaku
Węgiel
Palny
Mało reaktywny
Wchodzi w skład wszystkich związków organicznych Do nieorganicznych związków węgla należą m.in. jego tlenki oraz węglany
Typowy niemetal
Ciało stałe
Tworzy kilka odmian alotropowych, z których dwie: grafit i diament są najłatwiej dostępne…
... zobacz całą notatkę


Komentarze użytkowników (0)