To tylko jedna z 4 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
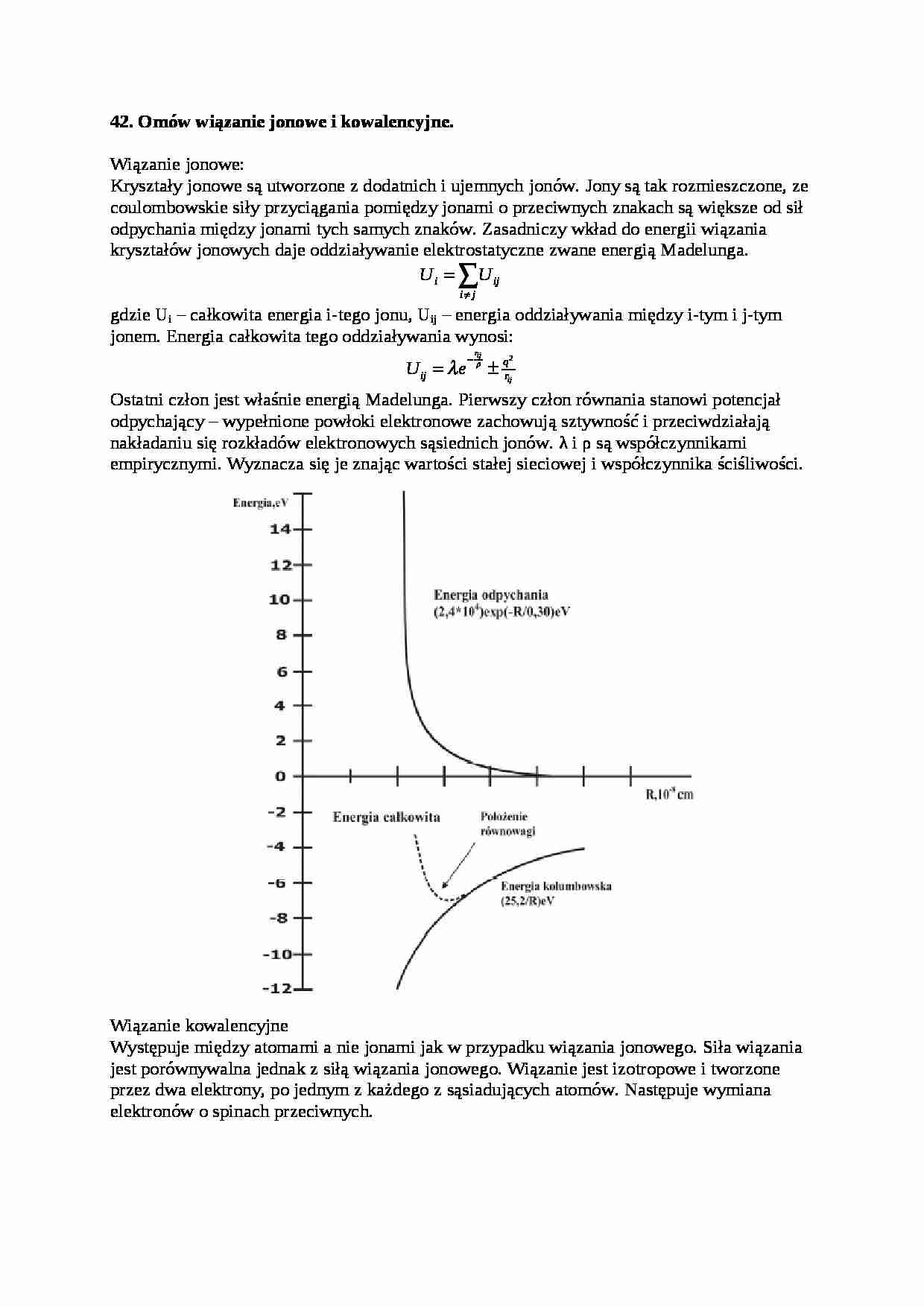


42. Omów wiązanie jonowe i kowalencyjne. Wiązanie jonowe: Kryształy jonowe są utworzone z dodatnich i ujemnych jonów. Jony są tak rozmieszczone, ze coulombowskie siły przyciągania pomiędzy jonami o przeciwnych znakach są większe od sił odpychania między jonami tych samych znaków. Zasadniczy wkład do energii wiązania kryształów jonowych daje oddziaływanie elektrostatyczne zwane energią Madelunga. i ij i j U U gdzie Ui – całkowita energia i-tego jonu, Uij – energia oddziaływania między i-tym i j-tym jonem. Energia całkowita tego oddziaływania wynosi: 2 rij ij q ij r U e Ostatni człon jest właśnie energią Madelunga. Pierwszy człon równania stanowi potencjał odpychający – wypełnione powłoki elektronowe zachowują sztywność i przeciwdziałają nakładaniu się rozkładów elektronowych sąsiednich jonów. λ i ρ są współczynnikami empirycznymi. Wyznacza się je znając wartości stałej sieciowej i współczynnika ściśliwości. Wiązanie kowalencyjne Występuje między atomami a nie jonami jak w przypadku wiązania jonowego. Siła wiązania jest porównywalna jednak z siłą wiązania jonowego. Wiązanie jest izotropowe i tworzone przez dwa elektrony, po jednym z każdego z sąsiadujących atomów. Następuje wymiana elektronów o spinach przeciwnych. Wiązanie metaliczne Kryształ o wiązaniu metalicznym można przedstawić jako zbiór jonów dodatnich zanurzonych w morzu elektronów. W przypadku metali przejściowych mogą występować dodatkowe siły wiązania wynikające z oddziaływań między wewnętrznymi powłokami elektronowymi.
... zobacz całą notatkę






Komentarze użytkowników (0)