To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
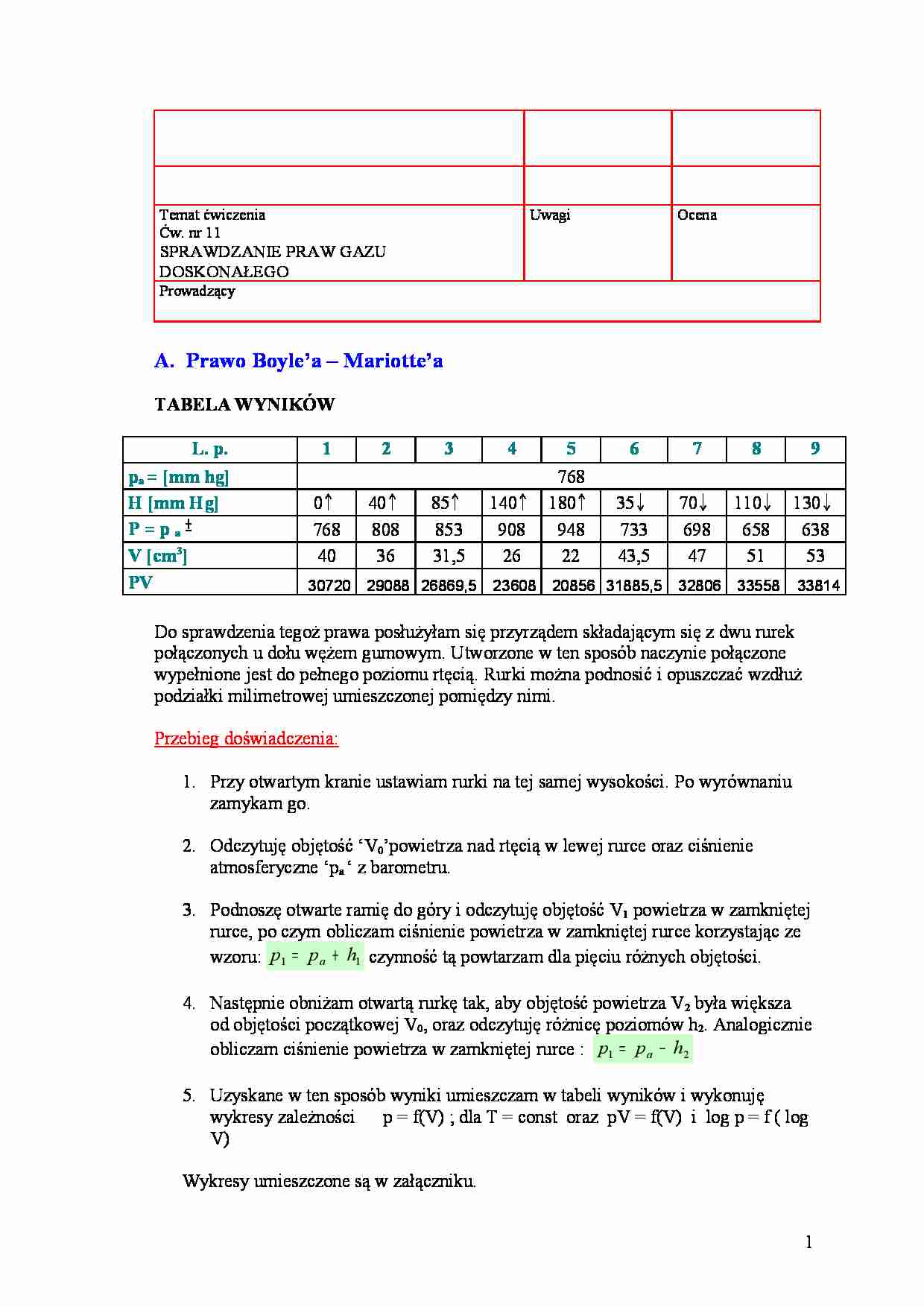


Temat ćwiczenia Ćw. nr 11 SPRAWDZANIE PRAW GAZU DOSKONAŁEGO Uwagi Ocena Prowadzący A. Prawo Boyle’a – Mariotte’a TABELA WYNIKÓW L. p. 1 2 3 4 5 6 7 8 9 pa = [mm hg] 768 H [mm Hg] 0 ↑ 40 ↑ 85 ↑ 140 ↑ 180↑ 35 ↓ 70 ↓ 110 ↓ 130↓ P = p a ± h[mmHg] ]]Hg] 768 808 853 908 948 733 698 658 638 V [cm3] 40 36 31,5 26 22 43,5 47 51 53 PV 30720 29088 26869,5 23608 20856 31885,5 32806 33558 33814 Do sprawdzenia tegoż prawa posłużyłam się przyrządem składającym się z dwu rurek połączonych u dołu wężem gumowym. Utworzone w ten sposób naczynie połączone wypełnione jest do pełnego poziomu rtęcią. Rurki można podnosić i opuszczać wzdłuż podziałki milimetrowej umieszczonej pomiędzy nimi. Przebieg doświadczenia: 1. Przy otwartym kranie ustawiam rurki na tej samej wysokości. Po wyrównaniu zamykam go. 2. Odczytuję objętość ‘V0’powietrza nad rtęcią w lewej rurce oraz ciśnienie atmosferyczne ‘pa ‘ z barometru. 3. Podnoszę otwarte ramię do góry i odczytuję objętość V1 powietrza w zamkniętej rurce, po czym obliczam ciśnienie powietrza w zamkniętej rurce korzystając ze wzoru: 1 1 h p p a + = czynność tą powtarzam dla pięciu różnych objętości. 4. Następnie obniżam otwartą rurkę tak, aby objętość powietrza V2 była większa od objętości początkowej V0, oraz odczytuję różnicę poziomów h2. Analogicznie obliczam ciśnienie powietrza w zamkniętej rurce : 2 1 h p p a − = 5. Uzyskane w ten sposób wyniki umieszczam w tabeli wyników i wykonuję wykresy zależności p = f(V) ; dla T = const oraz pV = f(V) i log p = f ( log V) Wykresy umieszczone są w załączniku. 1 B. Prawa Charlesa L. p. 1 2 3 4 5 6 7 8 9 10 11 12 13 p = pa + h [mmHg] 768,00 768,08 768,17 768,38 768,53 768,64 768,75 768,83 768,94 769,05 769,15 769,24 769,35 T [˚K] 298 303 308 313 318 323 328 333 338 343 348 353 358 L. p. 14 15 16 17 p = pa + h [mmHg] 769,43 769,54 769,61 769,69 T [˚K] 363 368 373 378 Doświadczenie przeprowadzam za pomocą urządzenia złożonego z hermetycznie zamkniętego naczynia wypełnionego powietrzem otoczonego poduszką elektryczną, połączonym z termostatem i barometrem rejestrującym zmiany ciśnienia zawartego w naczyniu gazu. Przebieg doświadczenia 1. Otwieram kran i wyrównuję ciśnienie w naczyniu z ciśnieniem atmosferycznym, odczytuję temperaturę termostatu ‘t 0 ‘oraz ciśnienie atmosferyczne ‘p a’ z
(…)
… wnioski, że ciśnienie powietrza
atmosferycznego zwiększa się proporcjonalnie wraz ze wzrostem temperatury.
Ciśnienie zmniejsza się natomiast w przypadku zwiększania objętości tej samej masy
gazu. Potwierdzeniem wysuniętych wniosków może być pionowy gradient ciśnienia w
strefach atmosfery ziemskiej, im wyżej będziemy to ciśnienie mierzyć tym będzie
mniejsze ponieważ atmosfera jest bardziej rozrzedzona tzn…
... zobacz całą notatkę






Komentarze użytkowników (0)